Как расставить коэффициенты в химических уравнениях 8. Урок по химии на тему расстановка коэффициентов в уравнениях химических реакций" (8 кл.)
Л егко ли расставлять коэффициенты в химических уравнениях?
егко ли расставлять коэффициенты в химических уравнениях?
Вот мои дети и доросли до химии (я классный руководитель в 8 «Б» классе). Химию чаще всего ребятам ставят на первом уроке , а в четверг у меня нет первого урока, и я попросился на урок к Валентине Ивановне «на детей посмотреть» и проверить дневники. Тема меня увлекла, в школе я любил химию, и дневники я не проверил. В очередной раз я убедился , что учащиеся чаще всего испытывают затруднения из-за того, что не видят межпредметных связей. На этом уроке химии учащиеся должны были составить химические уравнения, зная валентность химических веществ. И многие учащиеся испытали затруднения при определении числовых коэффициентов. Следующий урок химии в субботу мы с Валентиной Ивановной провели вместе.
Упражнение 1.
Запишите в виде химических уравнений следующие предложения:
А) «При обжиге карбоната кальция образуются оксид кальция и оксид углерода (IV)»; б) «При взаимодействии оксида фосфора (V) с водой получается фосфорная кислота».
Решение:
А) CaCO 3 = CaO + CO 2 - реакция эндотермическая. С этим заданием затруднений не оказалось, так как не нужно было подыскивать числовые коэффициенты. Изначально в левой и правой частях равенства по одному атому кальция по одному атому углерода и по три атома кислорода.
Б) P 2 O 5 + 3H 2 O = 2H 3 PO 4 - реакция экзотермическая. Со вторым уравнение возникли проблемы , без числовых коэффициентов не получилось верное равенство: P 2 O 5 + H 2 O → H 3 PO 4 . Очевидно , что для составления верного равенства нужно подбирать числовые коэффициенты. Если подбирать, то можно начать с фосфора: слева два атома, а справа – один, поэтому перед формулой азотной кислоты поставим числовой множитель, равный двум и тогда получим: P 2 O 5 + H 2 O → 2H 3 PO 4 . Но теперь осталось уравнять число атомов кислорода и водорода: водорода слева два атома , а справа - шесть атомов, поэтому перед формулой воды поставим числовой коэффициент, равный трём и тогда получим: P 2 O 5 + 3H 2 O → 2H 3 PO 4 . Теперь легко убедиться, что в каждой из частей уравнения равные количества и атомов фосфора и атомов водорода и атомов кислорода , следовательно, мы получили верное уравнение химической реакции: P 2 O 5 + 3H 2 O = 2H 3 PO 4 .
Второй способ: алгебраический. Предположим, что в уравнении поставили три коэффициента а, в, с , что получилось верное уравнение химической реакции: а P 2 O 5 + в H 2 O = с H 3 PO 4 . Так как в уравнении используются атомы трёх видов, то составим систему из трёх линейных уравнений с тремя неизвестными а, в и с .
Вещества, которые использовались в химической реакции: Р – фосфор; О 2 – кислород ; P 2 O 5 – оксид фосфора (V).
В) Fe 2 (SO 4) 3 + KOH → Fe(OH) 3 + K 2 SO 4 .
Вещества, которые использовались в химической реакции: Fe 2 (SO 4) 3 – сульфат железа (III); KOH – гидроксид калия; Fe(OH) 3 – гидроксид железа (III); K 2 SO 4 – сульфат калия.
Г) CuOH → Cu 2 O + H 2 O.
Решение:
2CuOH = Cu 2 O + H 2 O. Задачу по определению числовых коэффициентов решали , составляя систему уравнений: 
Вещества, которые использовались в химической реакции: CuOH – гидроксид меди (I); Cu 2 O – оксид меди (I); H 2 O – вода.
Д) CS 2 + O 2 → CO 2 + SO 2 .
Решение : CS 2 + 3O 2 = CO 2 + 2SO 2 . Решали подбором коэффициентов: уравняли число атомов серы (2); уравняли число атомов кислорода (3).
Вещества, которые использовались в химической реакции: CS 2 – сульфид серы (IV); O 2 –
Вещества, которые использовались в химической реакции: FeS 2 – колчедан; O 2 – кислород; Fe 2 O 3 – оксид железа (III); SO 2 - оксид серы (IV).
Упражнение 3.
(Было предложено для решения как самостоятельная работа).
Условие:
Запишите уравнения химических реакций по следующим схемам:
А) фосфорная кислота + гидроксид натрия → фосфат натрия + вода;
Б) оксид натрия + вода → гидроксид натрия;
В) оксид железа (II) + алюминий → оксид алюминия + железо;
Г) гидроксид меди (II)→ оксид меди (II) + вода.
Ответ:
А) 2H 3 PO 4 + 6NaOH = 2Na 3 PO 4 + 6H 2 O;
Б) Na 2 O + H 2 O = 2NaOH;
В) 3FeO + 2Al = Al 2 O 3 + 3Fe;
Г) Cu(OH) 2 = CuO + H 2 O.
За 10 минут 85% учащихся справились с заданием на «отлично», что приятно удивило Валентину Ивановну.
Существует несколько методов определения коэффициентов в уравнениях окислительно-восстановительных реакций. Мы используем метод электронного баланса, при котором составление полного уравнения ОВР проводится в следующей последовательности:
1. Составляют схему реакции, указав вещества, вступившие в реакцию, и вещества, получившиеся в результате реакции, например:
2. Определяют степень окисления атомов и пишут ее знак и величину над символами элементов, отмечая элементы, степень окисления которых изменилась:
3. Записывают электронные уравнения реакций окисления и восстановления, определяют число электронов, отданных восстановителем и принятых окислителем, и затем уравнивают их, умножая на соответствующие коэффициенты:
4. Полученные коэффициенты, отвечающие электронному балансу, переносят в основное уравнение:
5.Уравнивают число атомов и ионов, не меняющих степени окисления (в последовательности: металлы, неметаллы, водород):
6.Проверяют правильность подбора коэффициентов по числу атомов кислорода в левой и правой части уравнения реакции – они должны быть равны (в этом уравнении 24 = 18 + 2 + 4, 24 = 24).
Рассмотрим более сложный пример:
Определим степени окисления атомов в молекулах:
Составим электронные уравнения реакций окисления и восстановления и уравняем число отданных и принятых электронов:
Перенесем коэффициенты в основное уравнение:
Уравняем число атомов, не меняющих степень окисления:
Подсчитав число атомов кислорода в правой и левой части уравнения, убедимся, что коэффициенты подобраны правильно.
Важнейшие окислители и восстановители
Окислительно-восстановительные свойства элементов зависят от строения электронной оболочки атомов и определяются их положением в периодической системе Менделеева.
Металлы, имея на внешнем энергетическом уровне 1-3 электрона, легко их отдают и проявляют только восстановительные свойства. Неметаллы (элементы IV-VII групп) могут как отдавать, так и принимать электроны, поэтому они могут проявлять и восстановительные и окислительные свойства. В периодах с увеличением порядкового номера элемента восстановительные свойства простых веществ ослабевают, а окислительные усиливаются. В группах с повышением порядкового номера восстановительные свойства усиливаются, а окислительные ослабевают. Таким образом, из простых веществ лучшими восстановителями являются щелочные металлы, алюминий, водород, углерод; лучшими окислителями являются галогены и кислород .
Окислительно-восстановительные
свойства сложных веществ зависят от
степени окисления атомов, входящих в
их состав. Вещества,
содержащие атомы с низшей степенью
окисления, проявляют восстановительные
свойства
.
Важнейшими восстановителями являются
оксид углерода
 ,
сероводород
,
сероводород ,
сульфат железа(II)
,
сульфат железа(II)
 .Вещества,
в состав которых входят атомы с высшей
степенью окисления, проявляют окислительные
свойства
.
Важнейшими окислителями являются
перманганат калия
.Вещества,
в состав которых входят атомы с высшей
степенью окисления, проявляют окислительные
свойства
.
Важнейшими окислителями являются
перманганат калия
 ,
дихромат калия
,
дихромат калия ,
пероксид водорода
,
пероксид водорода ,
азотная кислота
,
азотная кислота ,
концентрированная серная кислота
,
концентрированная серная кислота .
.
Вещества,
содержащие атомы с промежуточной
степенью окисления, могут вести себя
как окислители или восстановители
в зависимости от свойств веществ, с
которыми они взаимодействуют, и условий
протекания реакции. Так в реакции с
 сернистая кислота проявляет
восстановительные свойства:
сернистая кислота проявляет
восстановительные свойства:
а при взаимодействии с сероводородом является окислителем:

Кроме того, для таких веществ возможны реакции самоокисления-самовосстановления, протекающие с одновременным увеличением и уменьшением степени окисления атомов одного и того же элемента, например:
Сила многих
окислителей и восстановителей зависит
от рН среды. Например,
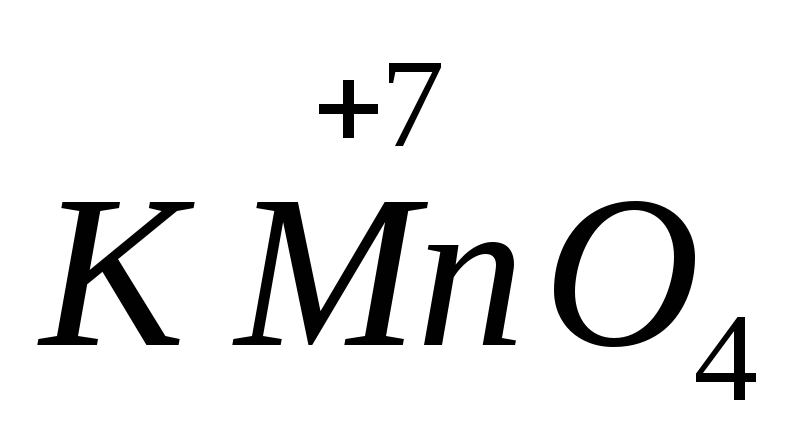 в щелочной среде восстанавливается до
в щелочной среде восстанавливается до ,
в нейтральной до
,
в нейтральной до ,
в присутствии серной кислоты - до
,
в присутствии серной кислоты - до .
.
Инструкция
Прежде чем приступать к самому заданию, нужно усвоить, что цифра, которая ставится перед химическим элементом или всей формулой коэффициентом. А цифра, стоящая (и чуть ) индекс. Кроме этого , что:
Коэффициент относится ко всем химическим символам, стоящим после него в формуле
Коэффициент умножается на индекс (не складывается!)
Атомов каждого элемента вступающих в реакцию веществ должно совпадать с числом атомов этих элементов, входящих в продуктов реакции.
Например, запись формулы 2H2SO4 означает 4 атома H (водорода), 2 атома S (серы) и 8 атомов O (кислорода).
1. Пример № 1. Рассмотрим горения этилена.
При сгорании органического вещества образуются оксид углерода (IV) (углекислый газ) и вода. Попробуем последовательно коэффициенты.
C2H4 + O2 => CO2+ H2O
Начинаем анализировать. В реакцию в ступило 2 атома С (углерода), а получился только 1 атом, значит перед CO2 ставим 2. Теперь их количество одинаково.
C2H4 + O2 => 2CO2+ H2O
Теперь смотрим на H (водород). В реакцию вступило 4 атома водорода, а получилось в результате только 2 атома, следовательно, перед H2O (водой) ставим 2 – теперь получилось тоже 4
C2H4 + O2 => 2CO2+ 2H2O
Считаем все атомы О (кислорода), образовавшиеся в результате реакции (то есть, после равенства). 4 атома в 2CO2 и 2 атома в 2H2O – всего 6 атомов. А до реакции всего 2 атома, значит, перед молекулой кислорода O2 ставим 3, а значит, их стало тоже 6.
C2H4 + 3O2 => 2CO2+ 2H2O
Таким образом, получилось одинаковое количество атомов каждого элемента до и после знака равенства.
C2H4 + 3O2 => 2CO2+ 2H2O
2. Пример № 2. Рассмотрим реакцию взаимодействия алюминия с разбавленной серной кислотой.
Al + H2SO4 => Al2 (SO4) 3 + H2
Смотрим на атомы S, входящие в состав Al2 (SO4) 3 - их 3, а в H2SO4 (серной кислоте) только 1, следовательно, и перед серной кислотой тоже ставим 3.
Al + 3H2SO4 => Al2 (SO4) 3 + H2
Зато теперь получилось до реакции 6 атомов H (водорода), а после реакции только 2, значит, перед молекулой H2 (водорода) ставим тоже 3, чтобы в целом получилось 6.
Al + 3H2SO4 => Al2 (SO4) 3 + 3H2
В последнюю очередь смотрим на . Так как в Al2 (SO4) 3 (сульфате алюминия) всего 2 атома алюминия, то и до реакции перед Al (алюминием) ставим 2.
2Al + 3H2SO4 => Al2 (SO4) 3 + 3H2
Теперь количество всех атомов до и после реакции совпадает. Оказалось, что расставлять коэффициенты в химических уравнениях не так и сложно. Достаточно потренироваться и все получится.
Обязательно учитывайте, что коэффициент умножается на индекс, а не складывается.
Источники:
- как элементы вступают в реакцию
- Тест по теме «Химические уравнения»
Для многих школьников написать уравнения химических реакций и правильно расставить коэффициенты нелегкая задача. Причем, главную трудность у них почему-то вызывает именно вторая ее часть. Казалось бы, ничего сложного в том нет, однако порой ученики пасуют, впадая в полную растерянность. А ведь надо всего лишь запомнить несколько простых правил, и задача перестанет вызывать затруднения.
Инструкция
Коэффициент, то есть число, стоящее перед формулой молекулы химического вещества, ко всем символам, и умножается на каждый каждого символа! Именно умножается, а не складывается! Это может показаться невероятным, но некоторые школьники складывают два числа вместо того, чтобы их перемножить.
Количество атомов каждого элемента исходных веществ (то есть находящихся в левой части уравнения) должно совпадать с количеством атомов каждого элемента продуктов реакции (соответственно, находящихся в его правой части).
Преподаватель, являясь главным действующим лицом в организации познавательной деятельности учащихся, постоянно находится в поиске путей повышения эффективности обучения. Организация эффективного обучения возможна только при знании и умелом использовании разнообразных форм педагогического процесса.
1. Современный человек должен обладать, не только суммой знаний и умений, но и способностью воспринимать мир как единое, сложное, постоянно развивающееся целое.
Скачать:
Предварительный просмотр:
Статья по химии: «Расстановка коэффициентов в химических уравнениях»
Составила: учитель химии
ГБОУ СОШ № 626
Казутина О.П.
Москва 2012
«Расстановка коэффициентов в химических уравнениях»
Преподаватель, являясь главным действующим лицом в организации познавательной деятельности учащихся, постоянно находится в поиске путей повышения эффективности обучения. Организация эффективного обучения возможна только при знании и умелом использовании разнообразных форм педагогического процесса.
1. Современный человек должен обладать, не только суммой знаний и умений, но и способностью воспринимать мир как единое, сложное, постоянно развивающееся целое.
Алгоритм работы по подготовке к проведению урока
выбор темы, определение целеполагания;
отбор содержания;
определение средств и путей развития у учащихся положительной мотивационной установки к работе на уроке;
конкретизация оснащения урока необходимым наглядным и дидактическим материалом;
разработка конспекта урока
Пример урока химии «Расстановка коэффициентов в химическом уравнении» для учителей
Цель: ответить на вопрос: «для чего надо расставлять коэффициенты в химическом уравнении»
Задачи:
Проблема необходимости расстановки коэффициентов
Алгоритм расстановки коэффициентов
Доказательство смысла расстановки коэффициентов
Ход урока:
Современный ученик, если он и учится, то относится к получаемым и перерабатываемым знаниям с прагматичностью. Поэтому предоставляемый материал должен уложиться в голове логично и лаконично.
Чтобы этого добиться, учителю всегда следует обращать внимание на то, зачем надо усвоить на уроке то или иное действие. То есть учитель должен объяснить. А потом, по – хорошему, дождаться правильных вопросов по новой теме.
Закон сохранения массы веществ
Знаменитый английский химик Р. Бойль, прокаливая в открытой реторте различные металлы и взвешивания их до и после нагревания, обнаружил, что масса металлов становится больше. Основываясь на этих опытах, он не учитывал роль воздуха и сделал неправильный вывод, что масса веществ в результате химических реакций изменяется. Р. Бойль утверждал, что существует какая-то "огненная материя", которая в случае нагревания металла соединяется с металлом, увеличивая массу.
Mg + O 2 MgO
24 г
40 г
М. В. Ломоносов в отличие от Р. Бойля прокаливал металлы не на открытом воздухе, а в запаянных ретортах и взвешивал их до и после прокаливания. Он доказал, что масса веществ до и после реакции остается без изменения и что при прокаливании к металлу присоединяется какая-то часть воздуха. (Кислород в то время не был еще открыт.) Результаты этих опытов он сформулировал в виде закона: "Все перемены,в натуре случающиеся, такого суть состояния, что сколько чего у одного тела отнимается столько присовокупится к другому". В настоящее время этот закон формулируется так:
Масса веществ, вступивших в химическую реакцию, равна массе образовавшихся веществ
Mg + O 2 MgO
24 г 32 г 40 г
Вопрос: закон не выполняется (т.к. не равны массы исходных и конечных веществ).
Решение этой проблемы – расстановка коэффициентов (целых чисел, показывающих количество молекул):
2Mg + O 2 2MgO
48 г 32 г 80 г – массы до и после равны благодаря тому, что число атомов элементов тоже равно до и после реакции.
Таким образом, доказав учащимся необходимость уравнивания масс коэффициентов, можно даже обойтись без некоторых предыдущих тем: составления формул веществ по валентности, расчета массы, количество вещества…Также рассказ о том, что закон сохранения массы вещества 20 лет спустя «переоткрыл» А. Лавуазье, уточнив его с одной стороны, но совершенно не обратив внимания на М.В. Ломоносова с этической, можно оставить на самостоятельное изучение в виде доклада, например.
Итак, для успешного выполнения заданий такого рода, необходимо усвоить условие: число атомов до реакции дб равно числу атомов после реакции: решим вместе:
H 2 S + 3O 2 SO 2 + 2H 2 O (удваиваем кислороды справа. Считаем их слева)
СН 4 + 2О 2 СО 2 + 2Н 2 О
Мы расставили коэффициенты в уравнениях горения двух газов
Сегодня мы поговорим о том, как расставлять коэффициенты в химических уравнениях. Данный вопрос интересует не только старшеклассников общеобразовательных учреждений, но и ребят, которые только знакомятся с основными элементами сложной и интересной науки. Если на первом этапе понять, в будущем проблем с решением задач не появится. Давайте разбираться с самого начала.
Что такое уравнение
Под ним принято подразумевать условную запись химической реакции, протекающей между выбранными реагентами. Для такого процесса используют индексы, коэффициенты, формулы.
Алгоритм составления
Как оформить химические уравнения? Примеры любых взаимодействий можно написать, суммируя исходные соединения. Знак равенства свидетельствует о том, что между реагирующими веществами протекает взаимодействие. Далее составляется формула продуктов по валентности (степени окисления).
Как записать реакцию
Например, если нужно записать химические уравнения, подтверждающие свойства метана, выбираем следующие варианты:
- галогенирование (радикальное взаимодействие с элементом VIIA периодической таблицы Д. И. Менделеева);
- горение в кислороде воздуха.
Для первого случая в левой части пишем исходные вещества, в правой - полученные продукты. После проверки числа атомов каждого химического элемента получаем конечную запись происходящего процесса. При горении метана в кислороде воздуха происходит экзотермический процесс, в результате которого образуется углекислый газ и водяной пар.
Для того чтобы правильно поставить коэффициенты в химических уравнениях, используется закон сохранения массы веществ. Начинаем процесс уравнивания с определения количества атомов углерода. Далее проводим расчеты для водорода и только после этого проверяем количество кислорода.
ОВР
Сложные химические уравнения можно уравнять, вооружившись методом электронного баланса или полуреакций. Предлагаем последовательность действий, предназначенную для расстановки коэффициентов в реакциях следующих типов:
- разложения;
- замещения.

Сначала важно расставить у каждого элемента в соединении степени окисления. При их расстановке необходимо учитывать некоторые правила:
- У простого вещества она равна нулю.
- В бинарном соединении их сумма равна 0.
- В соединении из трех и более элементов у первого проявляется положительная величина, у крайнего иона - отрицательное значение степени окисления. Центральный элемент высчитывают математическим путем, учитывая, что в сумме должен быть 0.
Далее выбирают те атомы либо ионы, у которых изменился показатель степени окисления. Знаками «плюс» и «минус» показывают количество электронов (принятых, отданных). Далее между ними определяется наименьшее кратное. При делении НОК на эти цифры получают числа. Данный алгоритм и будет ответом на вопрос о том, как расставлять коэффициенты в химических уравнениях.
Первый пример
Допустим, дано задание: «Расставьте коэффициенты в реакции, дополните пропуски, определите окислитель и восстановитель». Такие примеры предлагаются выпускникам школы, которые выбрали химию в качестве ЕГЭ.
KMnO 4 + H 2 SO 4 + KBr = MnSO 4 + Br 2 +…+…

Попробуем понять, как расставлять коэффициенты в химических уравнениях, предлагаемых будущим инженерам и медикам. После расстановки степеней окисления у элементов в исходных веществах и имеющихся продуктах получаем, что в качестве окислителя выступает ион марганца, а восстановительные свойства демонстрирует бромид-ион.
Делаем вывод о том, что пропущенные вещества не участвуют в окислительно-восстановительном процессе. Одним из недостающих продуктов является вода, а вторым станет сульфат калия. После составления электронного баланса завершающим этапом станет постановка коэффициентов в уравнении.
Второй пример
Приведем еще один пример, чтобы понять, как расставлять коэффициенты в химических уравнениях окислительно-восстановительного вида.
Допустим, дана следующая схема:
P + HNO 3 = NO 2 + … + …
Фосфор, который по условию является простым веществом, проявляет восстановительные свойства, повышая степень окисления до +5. Поэтому одним из пропущенных веществ будет фосфорная кислота H 3 PO 4. ОВР предполагает наличие восстановителя, которым будет выступать азот. Он переходит в оксид азота (4), образуя NO 2

Для того чтобы поставить в этой реакции коэффициенты, составим электронный баланс.
P 0 отдает 5e = P +5
N +5 принимает e = N +4
Учитывая, что перед азотной кислотой и оксидом азота (4) должен стоять коэффициент 5, получаем готовую реакцию:
P + 5HNO 3 =5NO 2 + H 2 O + H 3 PO 4
Стереохимические коэффициенты в химии позволяют решать разнообразные расчетные задачи.
Третий пример
Учитывая, что расстановка коэффициентов вызывает у многих старшеклассников затруднения, необходимо отрабатывать последовательность действий на конкретных примерах. Предлагаем еще один пример задания, выполнение которого предполагает владение методикой расстановки коэффициентов в окислительно-восстановительной реакции.
H 2 S + HMnO 4 = S + MnO 2 +…

Особенность предложенного задания в том, что необходимо дополнить пропущенный продукт реакции и только после этого можно переходить к постановке коэффициентов.
После расстановки степеней окисления у каждого элемента в соединениях можно сделать вывод, что окислительные свойства проявляет марганец, понижающий валентность. Восстановительную способность в предложенной реакции демонстрирует сера, восстанавливаясь до простого вещества. После составления электронного баланса нам останется только расставить коэффициенты в предлагаемую схему процесса. И дело сделано.
Четвертый пример
Химическое уравнение называют полным процессом в том случае, когда в нем в полном объеме соблюдается закон сохранения массы веществ. Как проверить эту закономерность? Количество атомов одного вида, которые вступили в реакцию, должно соответствовать их числу в продуктах взаимодействия. Только в этом случае можно будет вести речь о полноценности записанного химического взаимодействия, возможности его применения для проведения вычислений, решения расчетных задач разного уровня сложности. Приведем вариант задания, предполагающего расстановку в реакции недостающих стереохимических коэффициентов:
Si + …+ HF = H 2 SiF 6 + NO +…

Сложность задания в том, что пропущены и исходные вещества, и продукты взаимодействия. После постановки всех элементов степеней окисления видим, что восстановительные свойства проявляет в предлагаемом задании атом кремния. Среди продуктов реакции присутствует азот (II), одним из исходных соединений является азотная кислота. Логическим путем определяем, что недостающим продуктом реакции является вода. Завершающим этапом будет расстановка полученных стереохимических коэффициентов в реакцию.
3Si + 4HNO 3 + 18HF = 3H 2 SiF 6 + 4NO + 8 H 2 O
Пример задачи на уравнение
Нужно определить объем 10 % раствора хлороводорода, плотность которого составляет 1,05 г/мл, необходимый для полной нейтрализации гидроксида кальция, образующегося в процессе гидролиза его карбида. Известно, что газ, выделяющийся в ходе гидролиза, занимает объем 8,96 л (н. у.) Для того чтобы справиться с поставленным заданием, необходимо сначала составить уравнение процесса гидролиза карбида кальция:
CaC 2 + 2H 2 O = Ca (OH) 2 + C 2 H 2
Гидроксид кальция вступает во взаимодействие с хлороводородом, происходит полная нейтрализация:
Ca (OH) 2 + 2HCl = CaCl 2 + 2H 2 O

Вычисляем массу кислоты, которая потребуется для данного процесса. Определяем объем раствора хлороводорода. Все расчеты по задаче проводятся с учетом стереохимических коэффициентов, что подтверждает их важность.
В заключение
Анализ результатов единого государственного экзамена по химии свидетельствует о том, что задания, связанные с постановкой стереохимических коэффициентов в уравнениях, составление электронного баланса, определение окислителя и восстановителя вызывают серьезные затруднения у современных выпускников общеобразовательных школ. К сожалению, степень самостоятельности современных выпускников практически минимальна, поэтому отработку теоретической базы, предложенной педагогом, старшеклассники не проводят.
Среди типичных ошибок, которые допускают школьники, расставляя коэффициенты в реакциях разного типа, много математических погрешностей. Например, не все умеют находить наименьшее общее кратное, правильно делить и умножать числа. Причина подобного явления в уменьшении количества часов, выделяемых в образовательных школах на изучение данной темы. При базовой программе по химии у педагогов нет возможности отрабатывать со своими школьниками вопросы, касающиеся составления электронного баланса в окислительно-восстановительном процессе.