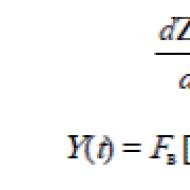
A szigorú kísérlet eredményei. A gázmolekulák sebessége
5. előadás
A gázmolekulák számos ütközésének eredményeképpen egymással (~10 9 ütközés 1 másodpercenként) és az edény falával a molekulák bizonyos sebesség szerinti statisztikai eloszlása jön létre. Ebben az esetben a molekulasebesség-vektorok minden iránya egyformán valószínűnek bizonyul, és a sebességmodulok és azok koordinátatengelyekre való vetületei bizonyos törvényeknek engedelmeskednek.
Az ütközések során a molekulák sebessége véletlenszerűen változik. Kiderülhet, hogy az ütközések sorozatában az egyik molekula más molekuláktól kap energiát, és energiája lényegesen nagyobb lesz, mint az adott hőmérsékleten mért átlagos energiaérték. Egy ilyen molekula sebessége nagy lesz, de még mindig véges lesz, mivel a maximális lehetséges sebesség a fénysebesség - 3·10 8 m/s. Következésképpen egy molekula sebessége általában 0-tól néhányig terjedhet υ max. Vitatható, hogy az átlagos értékekhez képest nagyon nagy sebességek ritkák, csakúgy, mint a nagyon kicsik.
Ahogy az elmélet és a kísérletek mutatják, a molekulák sebesség szerinti eloszlása nem véletlenszerű, hanem egészen határozott. Határozzuk meg, hogy hány molekulának, vagy a molekulák melyik részének van olyan sebessége, amely egy adott intervallumban, egy adott sebesség közelében található.
Adott tömegű gáz tartalmazzon N molekulák, míg dN A molekulák sebessége a υ előtt υ +dυ. Nyilvánvalóan ez a molekulák száma dN arányos a molekulák teljes számával Nés a megadott sebességintervallum értéke dυ
Ahol a- arányossági együttható.
Az is nyilvánvaló, hogy dN sebességtől függ υ , mivel azonos méretű időközönként, de különböző abszolút sebességértékeknél a molekulák száma eltérő lesz (például: hasonlítsa össze a 20-21 éves és 99-100 éves korban élők számát). Ez azt jelenti, hogy az együttható a az (1) képletben a sebesség függvényének kell lennie.
![]()
Ezt figyelembe véve az (1)-et átírjuk a formába
![]() (2)
(2)
A (2)-ből kapjuk
 (3)
(3)
Funkció f(υ ) eloszlásfüggvénynek nevezzük. Fizikai jelentése a (3) képletből következik.
 ha (4)
ha (4)
Ennélfogva, f(υ ) egyenlő azoknak a molekuláknak a relatív hányadával, amelyek sebessége a sebességhez közeli egységnyi sebességintervallumban található υ . Pontosabban, az eloszlásfüggvény jelentése annak a valószínűsége, hogy bármely gázmolekula sebességgel rendelkezik egységnyi intervallum közeli sebesség υ . Ezért hívják valószínűségi sűrűség.
Integrálva (2) az összes sebességértékre 0-tól a kapott értékig
 (5)
(5)
Az (5)-ből az következik
 (6)
(6)
A (6) egyenletet nevezzük normalizálási feltétel funkciókat. Meghatározza annak valószínűségét, hogy egy molekula sebességértéke 0 és . A molekula sebességének van valami jelentése: ez az esemény megbízható és valószínűsége eggyel egyenlő.
Funkció f(υ ) Maxwell találta meg 1859-ben. Elnevezték Maxwell eloszlás:
 (7)
(7)
Ahol A– sebességtől nem függő együttható, m- molekulatömeg, T- gáz hőmérséklet. A (6) normalizálási feltétel segítségével meghatározhatjuk az együtthatót A:

Ha ezt az integrált vesszük, azt kapjuk A:

Az együttható figyelembevételével A A Maxwell-eloszlási függvény a következő formában van:
 (8)
(8)
Amikor növeli υ a (8)-ban szereplő tényező gyorsabban változik, mint ahogy nő υ 2. Ezért az eloszlásfüggvény (8) az origóban indul, egy adott sebességértéknél maximumot ér el, majd csökken, aszimptotikusan közelítve a nullához (1. ábra).

1. ábra. A molekulák Maxwell-eloszlása
sebesség szerint. T 2 > T 1
A Maxwell-eloszlási görbe segítségével grafikusan megkeresheti azoknak a molekuláknak a relatív számát, amelyek sebessége egy adott sebességtartományba esik. υ előtt dυ(1. ábra, az árnyékolt csík területe).
Nyilvánvaló, hogy a görbe alatti teljes terület megadja a molekulák teljes számát N. A (2) egyenletből (8) figyelembe véve megtaláljuk azoknak a molekuláknak a számát, amelyek sebessége a következő tartományba esik. υ előtt dυ
 (9)
(9)
A (8)-ból az is világos, hogy az eloszlásfüggvény konkrét formája a gáz típusától (a molekula tömegétől) függ. m) és a hőmérséklet, és nem függ a gáz nyomásától és térfogatától.
Ha egy izolált rendszert kivonunk az egyensúlyból és magára hagyjuk, akkor egy bizonyos idő elteltével az egyensúlyi állapotba kerül. Ezt az időszakot ún pihenő idő. Különböző rendszerek esetén más. Ha a gáz egyensúlyi állapotban van, akkor a molekulák sebesség szerinti eloszlása nem változik az idő múlásával. Az egyes molekulák sebessége folyamatosan változik, de a molekulák száma dN, melynek sebessége a től től tartományba esik υ előtt dυállandóan állandó marad.
A molekulák Maxwell-féle sebességeloszlása mindig akkor jön létre, amikor a rendszer eléri az egyensúlyi állapotot. A gázmolekulák mozgása kaotikus. A hőmozgás véletlenszerűségének pontos meghatározása a következő: a molekulák mozgása teljesen kaotikus, ha a molekulák sebessége Maxwell szerint oszlik el. Ebből következik, hogy a hőmérsékletet az átlagos mozgási energia határozza meg mégpedig kaotikus mozgások. Bármilyen nagy is az erős szél sebessége, attól még nem lesz „forró”. A legerősebb szél is lehet hideg és meleg is, mert a gáz hőmérsékletét nem a szél iránysebessége, hanem a molekulák kaotikus mozgásának sebessége határozza meg.
Az eloszlási függvény grafikonjából (1. ábra) jól látható, hogy azon molekulák száma, amelyek sebessége azonos d intervallumokban van υ , de közel különböző sebességgel υ , több, ha a sebesség υ megközelíti a függvény maximumának megfelelő sebességet f(υ ). Ezt a sebességet υ n-t a legvalószínűbbnek (legvalószínűbbnek) nevezzük.
Differenciáljuk (8)-t, és egyenlővé tegyük a deriváltot nullával:

Mert  ,
,
akkor az utolsó egyenlőség teljesül, ha:

 (10)
(10)
A (10) egyenlet akkor teljesül, ha:
ÉS 
Az első két gyök a függvény minimális értékeinek felel meg. Ezután a feltételből megtaláljuk az eloszlásfüggvény maximumának megfelelő sebességet:

Az utolsó egyenletből:
 (11)
(11)
Ahol R- univerzális gázállandó, μ - moláris tömeg.
A (11)-et figyelembe véve (8)-ból megkaphatjuk az eloszlásfüggvény maximális értékét
 (12)
(12)
A (11)-ből és (12)-ből az következik, hogy növekvő T vagy ha csökken m görbe maximum f(υ ) jobbra tolódik és kisebb lesz, de a görbe alatti terület állandó marad (1. ábra).
Számos probléma megoldásához célszerű a Maxwell-eloszlást csökkentett formában használni. Bemutatjuk a relatív sebességet:
Ahol υ - adott sebesség, υ n- a legvalószínűbb sebesség. Ezt figyelembe véve a (9) egyenlet a következőképpen alakul:
 (13)
(13)
(13) egy univerzális egyenlet. Ebben a formában az eloszlási függvény nem függ a gáz típusától vagy a hőmérséklettől.
Ív f(υ ) aszimmetrikus. A grafikonon (1. ábra) jól látható, hogy a legtöbb molekula sebessége nagyobb, mint υ n. A görbe aszimmetriája azt jelenti, hogy a molekulák számtani átlagsebessége nem egyenlő υ n. A számtani átlagsebesség egyenlő az összes molekula sebességének összegével osztva a számukkal:

Vegyük figyelembe, hogy a (2) szerint
![]()
 (14)
(14)
Az érték behelyettesítése (14)-be f(υ ) a (8)-ból megkapjuk a számtani átlagsebességet:
 (15)
(15)
A molekulák sebességének átlagos négyzetét úgy kapjuk meg, hogy kiszámítjuk az összes molekula sebességének négyzetösszege és a szám arányát:

Csere után f(υ ) a (8)-ból a következőket kapjuk:

Az utolsó kifejezésből megtaláljuk a négyzetes átlagsebességet:
 (16)
(16)
A (11), (15) és (16) összehasonlításból megállapíthatjuk, hogy és egyformán függenek a hőmérséklettől, és csak számértékekben térnek el egymástól: (2. ábra).

2. ábra. Maxwell-eloszlás az abszolút sebességértékeken
A Maxwell-eloszlás egyensúlyi állapotban lévő gázokra érvényes, a vizsgált molekulák számának kellően nagynak kell lennie. Kis számú molekula esetén a Maxwell-eloszlástól való jelentős eltérések (fluktuációk) figyelhetők meg.
A molekulasebességek első kísérleti meghatározását a zord 1920-ban. Stern eszköze két különböző sugarú hengerből állt, amelyeket ugyanarra a tengelyre szereltek fel. A hengerekből a levegőt mélyvákuumba pumpálták. A tengely mentén vékony ezüstréteggel bevont platinaszálat feszítettek ki. Amikor elektromos áramot vezettek át az izzószálon, az magas hőmérsékletre (~1200 o C) melegedett, ami az ezüstatomok elpárolgásához vezetett.

A belső henger falában keskeny hosszanti rés készült, amelyen a mozgó ezüstatomok haladtak át. A külső henger belső felületén lerakva jól látható vékony csíkot alkottak közvetlenül a résszel szemben.

A hengerek állandó ω szögsebességgel forogni kezdtek. Most a résen áthaladó atomok már nem közvetlenül a réssel szemben helyezkedtek el, hanem egy bizonyos távolsággal elmozdultak, mivel repülésük során a külső hengernek volt ideje egy bizonyos szögben elfordulni. Ha a hengerek állandó sebességgel forogtak, a külső hengeren lévő atomok által alkotott csík helyzete egy bizonyos távolsággal eltolódott l.

A részecskék leülepednek az 1. pontban, amikor a berendezés áll; amikor a berendezés forog, a részecskék a 2. pontban ülepednek.

A kapott sebességértékek megerősítették Maxwell elméletét. Ez a módszer azonban hozzávetőleges információt szolgáltatott a molekulák sebességeloszlásának természetéről.
A Maxwell-eloszlást kísérletekkel pontosabban igazolták Lammert, Easterman, Eldridge és Costa. Ezek a kísérletek egészen pontosan megerősítették Maxwell elméletét.
A sugárban lévő higanyatomok sebességének közvetlen mérését 1929-ben végezték Lammert. Ennek a kísérletnek a leegyszerűsített diagramja az ábrán látható. 3.

3. ábra. Lammert kísérletének diagramja
1 - gyorsan forgó korongok, 2 - keskeny rések, 3 - sütő, 4 - kollimátor, 5 - molekulák pályája, 6 - detektor
Két közös tengelyre szerelt 1 tárcsa sugárirányú 2 hornyokkal rendelkezik, amelyek egymáshoz képest szögben el vannak tolva φ . A résekkel szemben volt a 3. kemence, amelyben az olvadó fémet magas hőmérsékletre hevítették. A felhevített fématomok, jelen esetben a higany kirepültek a kemencéből, és a 4-es kollimátor segítségével a kívánt irányba irányították őket. Két rés jelenléte a kollimátorban biztosította a részecskék mozgását a korongok között egyenes úton 5. Ezt követően a korongok résein áthaladó atomokat rögzítettük 6 detektor segítségével. A teljes leírt berendezést mélyvákuumba helyeztük. .
Amikor a korongok állandó ω szögsebességgel forogtak, csak bizonyos sebességű atomok haladtak át szabadon a réseiken. υ . Mindkét résen áthaladó atomok esetében az egyenlőségnek teljesülnie kell:

ahol Δ t 1 - a molekulák korongok közötti repülési ideje, Δ t 2 - idő a lemezek szögben történő elfordítására φ . Akkor:
A korongok forgási szögsebességének megváltoztatásával bizonyos sebességgel molekulákat lehetett izolálni a nyalábtól υ , és a detektor által rögzített intenzitás alapján ítélje meg azok relatív tartalmát a nyalábban.
Ily módon lehetőség nyílt kísérletileg igazolni a molekulasebesség-eloszlás Maxwell-törvényét.
A 19. század második felében a molekulák Brown-féle (kaotikus) mozgásának vizsgálata nagy érdeklődést váltott ki az akkori elméleti fizikusok körében. A James skót tudós által kifejlesztett anyag, bár általánosan elfogadott volt az európai tudományos körökben, csak hipotetikus formában létezett. Akkor még nem volt gyakorlati megerősítés. A molekulák mozgása továbbra is elérhetetlen maradt a közvetlen megfigyelés számára, sebességük mérése pedig egyszerűen megoldhatatlan tudományos problémának tűnt.
Ezért tartották kezdetben alapvetőnek azokat a kísérleteket, amelyek a gyakorlatban bizonyították az anyag molekulaszerkezetének tényét és meghatározták láthatatlan részecskéi mozgási sebességét. Az ilyen kísérletek döntő jelentősége a fizikai tudomány számára nyilvánvaló volt, mivel lehetővé tette az akkori egyik legfejlettebb elmélet - a molekuláris kinetika - érvényességének gyakorlati igazolását és bizonyítását.
A huszadik század elejére a világtudomány kellő fejlettségi szintet ért el ahhoz, hogy valós lehetőségek nyíljanak meg Maxwell elméletének kísérleti igazolására. Otto Stern német fizikus 1920-ban a francia Louis Dunoyer által 1911-ben feltalált molekulasugaras módszerrel meg tudta mérni az ezüst gázmolekulák mozgási sebességét. Stern kísérlete cáfolhatatlanul igazolta a törvény érvényességét, melynek eredményei megerősítették az atomok értékelésének helyességét, amely Maxwell hipotetikus feltevéseiből következett. Igaz, Stern tapasztalatai csak nagyon hozzávetőleges információkkal szolgálhatnak a sebességfokozatok természetéről. A tudománynak további kilenc évet kellett várnia a részletesebb információkra.

Lammert 1929-ben nagyobb pontossággal tudta ellenőrizni az eloszlási törvényt, aki némileg javította Stern kísérletét azáltal, hogy egy molekulanyalábot átvezetett pár forgó korongon, amelyeken sugárirányú lyukak voltak, és egy bizonyos szöggel eltolták egymáshoz képest. Az egység forgási sebességének és a furatok közötti szögnek a megváltoztatásával Lammert képes volt elkülöníteni a nyalábból az egyes molekulákat, amelyek eltérő sebességi jellemzőkkel rendelkeznek. De Stern tapasztalatai alapozták meg a kísérleti kutatásokat a molekuláris kinetikai elmélet területén.

1920-ban készült el az első ilyen jellegű kísérletek elvégzéséhez szükséges kísérleti installáció. Egy pár hengerből állt, amelyeket Stern személyesen tervezett. A készülék belsejében ezüsttel bevont vékony platina rudat helyeztek el, amely a tengely elektromos melegítésekor elpárolog. A berendezés belsejében kialakított vákuumkörülmények között keskeny ezüstatomnyaláb haladt át a hengerek felületén lévő hosszanti résen, és egy speciális külső képernyőn ülepedt. Természetesen az egység mozgásban volt, és amíg az atomok a felszínre értek, sikerült egy bizonyos szögben elfordulnia. Stern így határozta meg mozgásuk sebességét.
De nem ez az egyetlen tudományos eredménye Otto Sternnek. Egy évvel később Walter Gerlach-al együtt végzett egy kísérletet, amely megerősítette a spin jelenlétét az atomokban, és bebizonyította a térbeli kvantálás tényét. A Stern-Gerlach kísérlet egy speciális kísérleti rendszer létrehozását követelte meg, amelynek középpontjában az erő áll. Az erős komponens által generált mágneses tér hatására saját mágneses spinjük irányának megfelelően elhajlottak.
Év. A kísérlet volt az egyik első gyakorlati bizonyítéka az anyag szerkezetének molekuláris kinetikai elméletének érvényességének. Közvetlenül mérte a molekulák hőmozgásának sebességét, és megerősítette a gázmolekulák sebesség szerinti eloszlását.
A kísérlet elvégzéséhez Stern két különböző sugarú hengerből álló eszközt készített, amelyek tengelye egybeesett, és egy ezüstréteggel bevont platinahuzalt helyeztek rá. A hengerek belsejében a levegő folyamatos pumpálásával kellően alacsony nyomást tartottak fenn. Amikor elektromos áramot vezettek át a vezetéken, az ezüst olvadáspontja elérte az ezüst olvadáspontját, aminek következtében az ezüst elkezdett párologni, és az ezüstatomok egyenletesen és egyenesen, sebességgel repültek a kis henger belső felületére. v, amelyet a platinahuzal melegítési hőmérséklete, azaz az ezüst olvadáspontja határozza meg. A belső hengerben keskeny rés készült, amelyen keresztül az atomok akadálytalanul repülhettek tovább. A hengerek falait speciálisan hűtötték, ami hozzájárult a rájuk eső atomok leülepedéséhez. Ebben az állapotban a nagy henger belső felületén egy meglehetősen átlátszó keskeny ezüst plakett csík alakult ki, amely közvetlenül a kis henger résével szemben helyezkedik el. Ezután az egész rendszer egy bizonyos kellően nagy szögsebességgel forogni kezdett ω . Ebben az esetben a plakk sáv a forgási iránnyal ellentétes irányba tolódott el, és elvesztette tisztaságát. Az elmozdulás mérésével s a csík legsötétebb részét a rendszer nyugalmi helyzetéből kiindulva Stern meghatározta a repülési időt, ami után meghatározta a molekulák mozgási sebességét:
,
Ahol s- csíkeltolás, l- a hengerek közötti távolság, és u- a külső henger pontjainak mozgási sebessége.
Az így talált ezüstatomok mozgási sebessége egybeesett a molekulakinetikai elmélet törvényei szerint számított sebességgel, és az a tény, hogy a kapott csík elmosódott, arról tanúskodott, hogy az atomok sebessége eltérő és eloszlása szerint egy bizonyos törvény - Maxwell eloszlási törvénye: atomok, a gyorsabban mozgó atomok a nyugalmi állapotban kapott csíkhoz képest kisebb távolságra tolódnak el, mint a lassabban mozgók.
Írjon véleményt a "Stern Experience" cikkről
Irodalom
- Fizikai kifejezések rövid szótára / Összeáll. A. I. Bolsun, rektor. M. A. Eljasevics. - Mn. : Felsőiskola, 1979. - P. 388. - 416 p. - 30.000 példány.
Linkek
- Landsberg. Alapfokú fizika tankönyv. 1. kötet. Mechanika. Hő. Molekuláris fizika. - 12. kiadás - M.: FIZMATLIT, 2001. - ISBN 5-9221-0135-8.
- Internet iskola Prosveshchenie.ru.(Orosz) (elérhetetlen link - sztori) . Letöltve: 2008. április 5.
- Szigorú tapasztalat- cikk a Great Soviet Encyclopedia-ból.
A Stern-kísérletet jellemző részlet
Így hát most az ágyán feküdt, nehéz, nagy, eltorzult fejét gömbölyded karjára támasztva, és nyitott szemmel gondolta, hogy a sötétségbe néz.Mivel Bennigsen, aki levelezett az uralkodóval, és a főhadiszálláson a legnagyobb hatalommal rendelkezett, elkerülte őt, Kutuzov nyugodtabb volt abban az értelemben, hogy ő és csapatai nem kényszerülnek arra, hogy ismét haszontalan támadó akciókban vegyenek részt. A Kutuzov számára fájdalmasan emlékezetes tarutinói csata és előestéjének tanulsága is hathatott volna, gondolta.
„Meg kell érteniük, hogy csak akkor veszíthetünk, ha támadóan cselekszünk. Türelem és idő, ezek az én hőseim!” – gondolta Kutuzov. Tudta, hogy nem szabad almát szedni, amíg zöld. Éretten magától leesik, de ha zölden szeded, elrontod az almát és a fát, és a fogaidat is tönkreteszed. Tapasztalt vadászként tudta, hogy az állat megsebesült, megsebesült, hiszen csak az egész orosz haderő képes megsebesülni, de hogy halálos-e vagy sem, az még nem tisztázott kérdés. Most Lauriston és Berthelemy küldeményei és a partizánok jelentései szerint Kutuzov majdnem tudta, hogy halálosan megsebesült. De több bizonyítékra volt szükség, várnunk kellett.
„Szökni akarnak, hogy megnézzék, hogyan ölték meg. Várj és láss. Minden manőver, minden támadás! - azt gondolta. - Miért? Mindenki kiváló lesz. Biztos van valami szórakoztató a harcban. Olyanok, mint a gyerekek, akiktől nem lehet észhez térni, ahogy az is történt, mert mindenki be akarja bizonyítani, hogyan tud harcolni. Most nem ez a lényeg.
És mindezek milyen ügyes manővereket kínálnak nekem! Úgy tűnik nekik, hogy amikor kitaláltak két-három balesetet (emlékezett a pétervári általános tervre), akkor mindet kitalálták. És mindegyiknek nincs száma!”
A megválaszolatlan kérdés, hogy a Borodinóban ejtett seb végzetes-e vagy sem, Kutuzov feje fölött egy egész hónapja lógott. Egyrészt a franciák elfoglalták Moszkvát. Másrészt Kutuzov kétségtelenül egész lényével úgy érezte, hogy végzetesnek kellett volna lennie annak a szörnyű csapásnak, amelyben az egész orosz néppel együtt minden erejét megfeszítette. De mindenesetre bizonyíték kellett, és már egy hónapja várt rá, és minél tovább telt az idő, annál türelmetlenebb lett. Álmatlan éjszakáin az ágyán fekve ugyanazt tette, amit ezek a fiatal tábornokok tettek, amiért szemrehányást tett nekik. Minden lehetséges eshetőséget kitalált, amelyben Napóleonnak ez a bizonyos, már beteljesült halála kifejeződik. Ugyanúgy találta ki ezeket az esetlegességeket, mint a fiatalok, csak annyi különbséggel, hogy nem alapozott semmit ezekre a feltételezésekre, és nem kettőt-hármat, hanem ezreket látott. Minél tovább gondolkodott, annál többen jelentek meg. Előállt a napóleoni hadsereg mindenféle megmozdulásával, annak egészével vagy egy részével - Szentpétervár felé, ellene, megkerülve, előállt (amitől a legjobban félt) és annak esélyével, hogy Napóleon harcolni fog. a saját fegyvereivel, hogy Moszkvában maradjon, és várja őt. Kutuzov még azt is megálmodta, hogy Napóleon serege visszaköltözik Medynhez és Juhnovhoz, de egy dolgot nem láthatott előre, az volt, ami történt, Napóleon hadseregének őrült, görcsös rohanását moszkvai beszéde első tizenegy napjában – a dobás, amivel sikerült. lehetséges valami, amire Kutuzov még akkor sem mert gondolni: a franciák teljes kiirtására. Dorokhov jelentései Broussier hadosztályáról, a partizánoktól érkező hírek Napóleon hadseregének katasztrófáiról, pletykák a Moszkvából való indulás előkészületeiről – minden megerősítette azt a feltételezést, hogy a francia hadsereg vereséget szenvedett és menekülni készül; de ezek csak feltevések voltak, amelyek a fiatalok számára fontosnak tűntek, de Kutuzovnak nem. Hatvan éves tapasztalatával tudta, mekkora súlyt kell tulajdonítani a pletykáknak, tudta, hogy az emberek, akik akarnak valamit, mennyire képesek az összes hírt úgy csoportosítani, hogy megerősítsék azt, amit akarnak, és tudta, hogy ebben az esetben hogyan. hiányzik minden, ami ellentmond. És minél jobban akarta ezt Kutuzov, annál kevésbé engedte meg magának, hogy elhiggye. Ez a kérdés minden lelki erejét lefoglalta. Minden más csak az élet szokásos beteljesülése volt számára. Az élet ilyen megszokott beteljesülése és alárendeltsége volt a munkatársakkal folytatott beszélgetései, a m me Staelnek írt levelei, amelyeket Tarutinból írt, regények olvasása, díjak kiosztása, levelezése Szentpétervárral stb. n. De a franciák halála, amelyet egyedül ő látott előre, volt lelki, egyetlen vágya.
Képletekből
képletet kapunk egy monoatomos gáz molekuláinak négyzetes négyzetes sebességének kiszámításához:
ahol R az univerzális gázállandó.
Ez a gáz hőmérsékletétől és természetétől függ. Tehát 0 °C-on a hidrogén esetében ez 1800 m/s. nitrogén esetében - 500 m/s.
O. Stern volt az első, aki kísérleti úton meghatározta a molekulák sebességét. Abban a kamrában, amelyből a levegőt kiszívták, két koaxiális 1. és 2. henger található (1. ábra), amelyek egy tengely körül állandó szögsebességgel foroghatnak.

A tengely mentén ezüstözött platinahuzal van kifeszítve, amelyen elektromos áram folyik át. Felmelegszik és az ezüst elpárolog. Az ezüstatomok a 2. henger falában lévő 4-es nyíláson keresztül jutnak be az 1-es hengerbe, és leülepednek annak belső felületén, és a réssel párhuzamos keskeny csík formájában nyomot hagynak. Ha a hengerek álló helyzetben vannak, akkor a szalag a réssel szemben helyezkedik el (a 2. ábra B pontja, a) és ugyanolyan vastagságú.

Amikor a henger egyenletesen, szögsebességgel forog, a szalag a forgással ellentétes irányba s távolságot mozdul el a B ponthoz képest (2. ábra, b). Az 1. henger B pontja ezzel a távolsággal eltolódott a t idő alatt, ami szükséges ahhoz, hogy az ezüstatomok R - r távolságot tegyenek meg, ahol R és r az 1. és 2. henger sugarai.
ahol az 1. henger felületén lévő pontok lineáris sebessége. Ezért
Az ezüst atomok sebessége
![]()
R, r ismeretében és s kísérleti mérése után ezzel a képlettel kiszámítható az ezüstatomok átlagos mozgási sebessége. A Stern-kísérletben. Ez az érték egybeesik a molekulák négyzetgyökértékének elméleti értékével. Ez kísérleti bizonyítékul szolgál az (1) képlet, következésképpen a (3) képlet érvényességére.
Stern kísérletében kiderült, hogy egy forgó henger felületén a csík szélessége jóval nagyobb, mint a rés geometriai képe, és vastagsága különböző helyeken nem azonos (3. ábra, a). Ez csak azzal magyarázható, hogy az ezüstatomok különböző sebességgel mozognak. A bizonyos sebességgel repülő atomok elérik a B' pontot. A gyorsabban repülő atomok a 2. ábrán a B' pont felett, a lassabban repülő atomok pedig a B' pont alatt érnek véget. Így a kép minden pontja egy bizonyos sebességnek felel meg, ami tapasztalatból könnyen meghatározható. Ezzel magyarázható, hogy a henger felületén lerakódott ezüstatomok rétegének vastagsága nem mindenhol egyforma. A legnagyobb vastagság a réteg középső részén van, a széleken pedig csökken a vastagság.

Egy lerakódott ezüstcsík keresztmetszeti alakjának mikroszkóppal történő vizsgálata azt mutatta, hogy alakja megközelítőleg megfelel a 3. ábrán láthatónak, b. A lerakódott réteg vastagsága alapján meg lehet ítélni az ezüstatomok sebességeloszlását.
Osszuk fel az ezüstatomok kísérletileg mért sebességeinek teljes tartományát kicsikre. Legyen ennek az intervallumnak az egyik sebessége. A réteg sűrűségének felhasználásával kiszámítjuk azon atomok számát, amelyek sebessége -tól tartományban van, és ábrázoljuk a függvényt
![]()
ahol N a henger felületén lerakódott ezüstatomok teljes száma. A 4. ábrán látható görbét kapjuk. Ezt a molekulák sebességeloszlási függvényének nevezzük.

Az árnyékolt terület területe
![]()
azok. egyenlő a belül sebességgel rendelkező atomok relatív számával
Látjuk, hogy a különböző intervallumokból származó sebességű részecskék száma élesen különbözik. Van bizonyos sebesség, amelynek értéke körül a legnagyobb számú molekula mozgási sebessége van. Ezt nevezik a legvalószínűbb sebességnek, és a 4. ábrán látható maximumnak felel meg. Ez a görbe jól megfelel a J. Maxwell által kapott görbének, aki statisztikai módszerrel elméletileg bebizonyította, hogy termodinamikai állapotban lévő gázokban egyensúly, létrejön egy bizonyos érték, amely nem változik az időben, a molekulák sebesség szerinti eloszlása, amely engedelmeskedik egy jól meghatározott statisztikai törvénynek, amelyet a görbe grafikusan ábrázol. A legvalószínűbb sebesség, amint azt Maxwell kimutatta, a gáz hőmérsékletétől és molekuláinak tömegétől függ a képlet szerint
1 - platina huzal ezüstréteggel; 2 - ezüst atomok sugarát képező rés; 3 - lemez, amelyen ezüstatomok vannak lerakva; P és P1 a lerakott ezüstcsíkok helyzete, amikor a készülék áll és forog.
A kísérlet elvégzéséhez Stern két különböző sugarú hengerből álló eszközt készített, amelyek tengelye egybeesett, és egy ezüstréteggel bevont platinahuzalt helyeztek rá. A hengerek belsejében a levegő folyamatos pumpálásával kellően alacsony nyomást tartottak fenn. Amikor elektromos áramot vezettek át a vezetéken, az ezüst olvadáspontja elérte az ezüst olvadáspontját, aminek következtében az ezüst elkezdett párologni, és az ezüstatomok egyenletesen és egyenesen, sebességgel repültek a kis henger belső felületére. v (\displaystyle v), amelyet a platinahuzal hevítési hőmérséklete, azaz az ezüst olvadáspontja határozza meg. A belső hengerben keskeny rés készült, amelyen keresztül az atomok akadálytalanul repülhettek tovább. A hengerek falait speciálisan hűtötték, ami hozzájárult a rájuk eső atomok leülepedéséhez. Ebben az állapotban a nagy henger belső felületén egy meglehetősen átlátszó keskeny ezüst plakett csík alakult ki, amely közvetlenül a kis henger résével szemben helyezkedik el. Ezután az egész rendszer egy bizonyos kellően nagy szögsebességgel forogni kezdett ω (\displaystyle\omega). Ebben az esetben a plakk sáv a forgási iránnyal ellentétes irányba tolódott el, és elvesztette tisztaságát. Az elmozdulás mérésével s (\displaystyle s) a csík legsötétebb részét a rendszer nyugalmi helyzetéből kiindulva Stern meghatározta a repülési időt, ami után meghatározta a molekulák mozgási sebességét:
t = s u = l v ⇒ v = u l s = ω R b i g (R b i g − R s m a l l) s (\displaystyle t=(\frac (s)(u))=(\frac (l)(v))\Rightarrow v =(\frac (ul)(s))=(\frac (\omega R_(nagy)(R_(nagy)-R_(kicsi)))(s))),Ahol s (\displaystyle s)- csíkeltolás, l (\displaystyle l)- a hengerek közötti távolság, és u (\displaystyle u)- a külső henger pontjainak mozgási sebessége.
Az így talált ezüstatomok mozgási sebessége (584 m/s) egybeesett a molekulakinetikai elmélet törvényei szerint számított sebességgel, és az a tény, hogy a kapott csík elmosódott, arról tanúskodott, hogy az atomok sebessége különböznek és eloszlanak valamilyen törvény szerint – Maxwell eloszlási törvénye: a gyorsabban mozgó atomok a nyugalmi állapotban kapott csíkhoz képest kisebb távolságra mozdultak el, mint a lassabban mozgók. Ugyanakkor a tapasztalatok csak hozzávetőleges információt adtak a Maxwell-eloszlás természetéről, pontosabb kísérleti megerősítés 1930-ig nyúlik vissza (