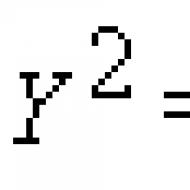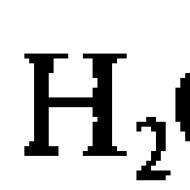Dissociation av vatten. PH värde
Rent vatten kan, även om det är dåligt (jämfört med elektrolytlösningar), leda elektrisk ström. Detta orsakas av en vattenmolekyls förmåga att sönderfalla (dissociera) till två joner, som är ledare av elektrisk ström i rent vatten (nedan betyder dissociation elektrolytisk dissociation - sönderdelning till joner): H 2 O ↔ H + + OH -
För cirka 556 000 000 icke-dissocierade vattenmolekyler dissocierar endast 1 molekyl, men detta är 60 000 000 000 dissocierade molekyler i 1 mm3. Dissociation är reversibel, det vill säga H + och OH - jonerna kan bilda en vattenmolekyl igen. Som ett resultat uppstår dynamisk jämvikt där antalet sönderfallna molekyler är lika med antalet bildade H + och OH - joner. Med andra ord kommer hastigheterna för båda processerna att vara lika. För vårt fall kan ekvationen för hastigheten för en kemisk reaktion skrivas på följande sätt:
υ 1 = κ 1 (för vattendissociation)
υ 2 = κ 2 (för den omvända processen)
där υ är reaktionshastigheten; K är reaktionshastighetskonstanten (beroende på reaktanternas natur och temperatur); , och - koncentrationer (mol/l).
I ett jämviktstillstånd υ 1 = υ 2, därför: κ 1 = κ 2
Eftersom, vid en viss temperatur, mängderna som används för att beräkna den joniska produkten av vatten (K, ) är konstanta, är värdet av den joniska produkten av vatten också konstant. Och eftersom dissociationen av en vattenmolekyl producerar samma antal joner och , visar det sig att för rent vatten kommer koncentrationerna och att vara lika med 10 -7 mol/l. Av konstansen för den joniska produkten av vatten följer att om antalet H + joner blir större, så blir antalet HO - joner mindre. Till exempel, om en stark syra HCl tillsätts till rent vatten, kommer den, som en stark elektrolyt, att helt dissociera i H + och Cl -, som ett resultat kommer koncentrationen av H + joner att öka kraftigt, och detta kommer att leda till en ökning av hastigheten för processen motsatt dissociation, eftersom den beror på koncentrationen av joner H + och OH -: υ 2 = κ 2
Under den accelererade processen som är motsatt dissociation kommer koncentrationen av HO - joner att minska till ett värde som motsvarar den nya jämvikten, vid vilken det kommer att finnas så få av dem att dissociationshastigheterna för vatten och den omvända processen återigen blir lika. Om koncentrationen av den resulterande HCl-lösningen är 0,1 mol/l blir jämviktskoncentrationen lika med: = 10 -14 /0,1 = 10 -13 mol/l
Jonisk produkt av vatteń är produkten av koncentrationerna av vätejoner H + och hydroxyljoner OH − i vatten eller i vattenlösningar, vattens autoprotolyskonstant.
Vatten, även om det är en svag elektrolyt, dissocierar i liten utsträckning:
Jämvikten i denna reaktion är starkt förskjuten åt vänster. Dissociationskonstanten för vatten kan beräknas med formeln:
· - koncentration av hydroniumjoner (protoner);
· - koncentration av hydroxidjoner;
· - koncentration av vatten (i molekylär form) i vatten;
Koncentrationen av vatten i vatten, med hänsyn till dess låga dissociationsgrad, är praktiskt taget konstant och uppgår till (1000 g/l)/(18 g/mol) = 55,56 mol/l.
Vid 25 °C är dissociationskonstanten för vatten 1,8 10 −16 mol/l. Ekvation (1) kan skrivas om som:
Konstanten K in, lika med produkten av koncentrationerna av protoner och hydroxidjoner, kallas den joniska produkten av vatten. Det är konstant inte bara för rent vatten, utan också för utspädda vattenlösningar av ämnen. Med ökande temperatur ökar dissociationen av vatten, därför ökar Kv också, med sjunkande temperatur - vice versa. Den praktiska betydelsen av den joniska produkten av vatten är stor, eftersom den gör det möjligt att, med en känd surhet (alkalinitet) för vilken lösning som helst (det vill säga vid en känd koncentration eller ), hitta motsvarande koncentration eller . Även om de i de flesta fall, för att underlätta presentationen, inte använder absoluta koncentrationsvärden, utan deras decimallogaritmer tagna med motsatt tecken - respektive väteindex (pH) och hydroxylindex (pOH).
Eftersom Kb är en konstant kommer koncentrationen av hydroxidjoner OH − att sjunka när syra (H + joner) tillsätts lösningen och vice versa. I en neutral miljö = = mol/l. Vid en koncentration > 10 −7 mol/l (respektive koncentrationen< 10 −7 моль/л) среда будет sur; Vid en koncentration > 10 −7 mol/l (respektive koncentrationen< 10 −7 моль/л) - alkalisk.
27. Buffertlösningar: deras sammansättning, egenskaper, verkningsmekanism. Buffertkapacitet
Buffertlösningar- Detta är lösningar som innehåller buffertsystem. Buffertsystem är blandningar som innehåller svaga syror och deras salter med starka baser eller svaga baser och deras salter med starka syror i ett visst kvantitativt förhållande. Sådana lösningar har en stabil koncentration av H+-joner när de späds ut med ett neutralt lösningsmedel (vatten) och en viss mängd starka syror eller baser tillsätts dem.
Buffertlösningar finns i vattnen i världshaven, jordlösningar och levande organismer. Dessa system utför funktionerna hos regulatorer som upprätthåller en aktiv reaktion av omgivningen vid ett visst värde som är nödvändigt för en framgångsrik förekomst av metaboliska reaktioner. Buffertlösningar klassificeras i sura och basiska. Ett exempel på det förra skulle vara ett acetatbuffertsystem och ett exempel på det senare skulle vara ett ammoniumbuffertsystem. Det finns naturliga och konstgjorda buffertlösningar. En naturlig buffertlösning är blod, som innehåller bikarbonat, fosfat, protein, hemoglobin och sura buffertsystem. En artificiell buffertlösning kan vara en acetatbuffert bestående av CH3COOH.
Låt oss överväga egenskaperna hos buffertsystemens interna sammansättning och verkningsmekanism med exemplet på ett acetatbuffertsystem: acetatsyra/natriumacetat. I en vattenhaltig miljö genomgår komponenterna i buffertsystemet elektrolytisk dissociation. Natriumacetat, som ett salt av en svag syra och en stark bas, dissocierar fullständigt till joner. Närvaron av anjoner i en sådan buffertblandning beror på koncentrationen av salt i den och graden av dess dissociation. Koncentrationen av H+-joner i buffertsystemet är direkt proportionell mot koncentrationen av syran i det och omvänt proportionell mot innehållet av saltet av denna syra i det.
Således är koncentrationen av H+-joner i huvudbufferten direkt proportionell mot koncentrationen av salt i den och omvänt proportionell mot koncentrationen av bas.
Till exempel är det nödvändigt att förbereda en acetatbuffert med flera pH-värden. Förbered först 5M lösningar av acetatsyra och natriumacetat. För att förbereda den första lösningen, ta 50 ml av varje komponent. Med hjälp av formeln bestämmer du koncentrationen av H+-joner i den resulterande lösningen.
För nästa buffertlösning, ta 80 ml sur lösning och 20 ml saltlösning beredd tidigare. Det finns ett antal recept för olika buffertlösningar som används i kemisk analys och laboratoriepraxis.
Buffertlösningar kännetecknas av vissa egenskaper. Dessa inkluderar först och främst buffring - förmågan att upprätthålla en konstant koncentration av H+-joner när en viss mängd av en stark syra eller stark bas tillsätts till en buffertlösning. Till exempel, om en liten mängd kloridsyra tillsätts till acetatbufferten, kommer pH inte att skifta till den sura sidan, eftersom kloridsyran kommer att genomgå en utbytesnedbrytningsreaktion med saltet av den svaga syran. Som ett resultat av reaktionen ersätts en stark syra som kan flytta pH till den sura sidan av en svag syra och ett neutralt salt. Graden av dissociation av en svag elektrolytlösning minskar när dess koncentration ökar, tenderar till noll och en pH-förskjutning inträffar inte.
Buffertlösningskapacitet(från engelska buffert- stötdämpare, engelska vältränad- mjuka upp stötar) - mängden syra eller bas som behövs för att ändra pH i buffertlösningen med exakt 1.
Buffertblandning, buffertlösning, buffertsystem- en kombination av ämnen, ett system som håller ett konstant pH.
Vatten- svag amfotär elektrolyt.
Ekvationen för jonisering av vatten med hänsyn till hydratiseringen av vätejoner H + är följande:
Utan att ta hänsyn till hydratiseringen av H +-joner har vattendissociationsekvationen formen:
![]()
Som framgår av den andra ekvationen är koncentrationerna av vätejoner H + och hydroxidjoner OH - i vatten desamma. Vid 25 o C [H+] = [OH -] = 10-7 mol/l.
Produkten av koncentrationerna av vätejoner och hydroxidjoner kallas jonisk produkt av vatten(KH2O).
K H2O = ∙
K H 2 O är ett konstant värde och vid en temperatur på 25 o C
KH2O = 10-7 ∙10-7 = 10-14
I utspädda vattenlösningar av elektrolyter, som i vatten, är produkten av koncentrationerna av vätejoner H + och hydroxidjoner OH - ett konstant värde vid en given temperatur. Den joniska produkten av vatten gör det möjligt för vilken vattenlösning som helst att beräkna koncentrationen av hydroxidjoner OH - om koncentrationen av vätejoner H + är känd, och vice versa.
Miljön för vilken vattenlösning som helst kan karakteriseras av koncentrationen av vätejoner H+ eller hydroxidjoner OH-.
Det finns tre typer av media i vattenlösningar: neutrala, alkaliska och sura.
Neutral miljöär ett medium där koncentrationen av vätejoner är lika med koncentrationen av hydroxidjoner:
[H+] = = 10-7 mol/l
Sur miljöär ett medium där koncentrationen av vätejoner är större än koncentrationen av hydroxidjoner:
[H+] > [OH-], > 10-7 mol/l
Alkalisk miljöär ett medium där koncentrationen av vätejoner är mindre än koncentrationen av hydroxidjoner:
< , < 10 -7 моль/л
För att karakterisera lösningsmiljöer är det lämpligt att använda det så kallade pH-värdet (pH).
PH värde kallas den negativa decimallogaritmen för koncentrationen av vätejoner: pH = -log.
Till exempel, om = 10 -3 mol/l, då pH = 3, är lösningsmediet surt; om [H + ] = 10 -12 mol/l, då pH = 12, är lösningsmediet alkaliskt: 
pH är mindre än 7, ju surare lösningen är. pH är högre än 7, ju högre alkalinitet lösningen har.
Sambandet mellan koncentrationen av H+-joner, pH-värdet och lösningsmiljön visas i följande diagram:

Det finns olika metoder för att mäta pH. Kvalitativt bestäms typen av mediet för vattenlösningar av elektrolyter med hjälp av indikatorer.
Indikatorerär ämnen som reversibelt ändrar sin färg beroende på lösningens miljö, d.v.s. lösningens pH.
I praktiken används indikatorer lackmus, metylorange (metylorange) och fenolftalein. De ändrar sin färg i ett litet pH-intervall: lackmus - i pH-intervallet från 5,0 till 8,0; metylorange - från 3,1 till 4,4 och fenolftalein - från 8,2 till 10,0.
Förändringen i färg på indikatorerna visas i diagrammet: 
De skuggade områdena visar omfånget av förändringar i färgen på indikatorn.

Förutom ovanstående indikatorer används också en universell indikator, som kan användas för att ungefär bestämma pH i ett brett intervall från 0 till 14.
pH-värdet har stor betydelse i kemiska och biologiska processer, eftersom dessa processer beroende på miljöns natur kan ske med olika hastigheter och i olika riktningar.
Därför är det mycket viktigt att bestämma pH för lösningar inom medicin, vetenskap, teknik och jordbruk. Att ändra pH i blod eller magsaft är ett diagnostiskt test inom medicin. Avvikelser av pH från normala värden, även med 0,01 enheter, indikerar patologiska processer i kroppen. Konstantiteten för koncentrationerna av vätejoner H + är en av de viktiga konstanterna i den inre miljön hos levande organismer.
Således, med normal surhet, har magsaft ett pH på 1,7; Humant blods pH är 7,4; saliv - 6,9. Varje enzym fungerar vid ett visst pH-värde: blodkatalas vid pH 7 magsaft pepsin - vid pH 1,5-2; etc.
Rent vatten kan, även om det är dåligt (jämfört med elektrolytlösningar), leda elektrisk ström. Detta orsakas av en vattenmolekyls förmåga att sönderfalla (dissociera) till två joner, som är ledare av elektrisk ström i rent vatten (nedan betyder dissociation elektrolytisk dissociation - sönderdelning till joner):
H 2 O ↔ H + + OH -
För cirka 556 000 000 icke-dissocierade vattenmolekyler dissocierar endast 1 molekyl, men detta är 60 000 000 000 dissocierade molekyler i 1 mm3. Dissociation är reversibel, det vill säga H + och OH - jonerna kan bilda en vattenmolekyl igen. Så småningom kommer det dynamisk jämvikt där antalet sönderfallna molekyler är lika med antalet bildade H + och OH - joner. Med andra ord kommer hastigheterna för båda processerna att vara lika. För vårt fall kan ekvationen för hastigheten för en kemisk reaktion skrivas på följande sätt:
υ 1 = κ 1 (för vattendissociation)
υ 2 = κ 2 (för den omvända processen)
Var υ - hastighetsreaktion; κ - reaktionshastighetskonstant (beroende på reaktanternas natur och temperatur); , Och - koncentration (mol/l).
I ett tillstånd av balans υ 1 = υ 2, därav:
κ 1 = κ 2
Låt oss göra lite enkel matematik och få:
κ 1 /κ 2 = /
K 1 / K 2 = K
K- jämviktskonstant, och i vårt fall dissociationskonstant, som beror på ämnenas temperatur och natur, och inte beror på koncentrationer (liksom κ 1 och κ 2). K för vatten 1,8 10 -16 vid 25 °C (referensvärde).
På grund av det mycket lilla antalet dissocierade molekyler, koncentrationen kan tas vara lika med den totala koncentrationen av vatten, och den totala koncentrationen av vatten i utspädda lösningar som ett konstant värde:
=1000(g/l)/18(g/mol)=55,6 mol/l.
Byter ut κ 1 / κ 2 på K och använda värdet , bestämmer vi vad produkten av koncentrationer är lika med Och som kallas - jonisk produkt av vatten:
K = /55,6 mol/l
1,8 10 -16 55,6 mol/l =
10 -14 =
Eftersom, vid en viss temperatur, de mängder som används för att beräkna den joniska produkten av vatten ( K, ) är konstanta, värdet av den joniska produkten av vatten precis samma hela tiden. Och eftersom dissociationen av en vattenmolekyl producerar samma antal joner Och , visar det sig att för rent vatten koncentrationen Och kommer att vara lika 10 -7 mol/l. Av konstansen för den joniska produkten av vatten följer att om antalet H + joner blir större, så blir antalet HO - joner mindre. Till exempel, om en stark syra HCl tillsätts till rent vatten, kommer den, som en stark elektrolyt, att helt dissociera i H + och Cl -, som ett resultat kommer koncentrationen av H + joner att öka kraftigt, och detta kommer att leda till en ökning av hastigheten för processen motsatt dissociation, eftersom den beror på koncentrationen av joner H+ och OH-:
υ 2 = κ 2
Under den accelererade processen som är motsatt dissociation kommer koncentrationen av HO - joner att minska till ett värde som motsvarar den nya jämvikten, vid vilken det kommer att finnas så få av dem att dissociationshastigheterna för vatten och den omvända processen återigen blir lika. Om koncentrationen av den resulterande HCl-lösningen är 0,1 mol/l, är jämviktskoncentrationen kommer att vara lika med:
= 10-14/0,1 = 10-13 mol/l
Vid tillsats av den starka basen NaOH kommer förskjutningen att ske mot en minskning av H+-koncentrationen.
Slut på arbetet -
Detta ämne hör till avsnittet:
Elektronmoln av orbitaler med olika värden på l har olika konfigurationer, och de med samma l har en liknande konfiguration
Modern kvantmekanisk teori säger att en atom av vilket element som helst har en komplex struktur; den positiva delen av atomen är en positiv laddning.. kvantteorin innebär att energin hos en elektron endast kan tas emot.. så vid l s, orbitalen för en elektron med vilket värde som helst av det huvudsakliga kvanttalet n, elektronmolnet är begränsat..
Om du behöver ytterligare material om detta ämne, eller om du inte hittade det du letade efter, rekommenderar vi att du använder sökningen i vår databas med verk:
Vad ska vi göra med det mottagna materialet:
Om detta material var användbart för dig kan du spara det på din sida på sociala nätverk:
| Tweet |
Alla ämnen i detta avsnitt:
Atomernas struktur och Pauli-principen
Pauli-principen hjälper till att förklara en mängd olika fysiska fenomen. En konsekvens av principen är närvaron av elektronskal i atomens struktur, varifrån i sin tur följer en mängd olika kemikalier
Grundläggande typer av kemiska bindningar. Kovalent bindning. Grundprinciper för valensbindningsmetoden. Sigma och pikovalenta bindningar
atomer kan kombineras med varandra för att bilda både enkla och komplexa ämnen. I detta fall bildas olika typer av kemiska bindningar: joniska, kovalenta (icke-polära och polära), metall
Sp-hybridisering
Uppstår när en s- och en p-orbital blandas. Två ekvivalenta sp-atomära orbitaler bildas, belägna linjärt i en vinkel på 180 grader och riktade i olika riktningar från atomkärnan
Geometrisk form och polaritet hos molekyler
Hybridisering Geometrisk form Vinkel mellan bindningar sp Linjär 180° sp
Jonbindning som ett begränsande fall av kovalent bindningspolarisering. Elektrostatisk interaktion av joner
En jonbindning är en mycket stark kemisk bindning som bildas mellan atomer med en stor skillnad (>1,5 på Pauling-skalan) av elektronegativitet, vid vilken det delade elektronparet
Kemiska egenskaper hos basiska oxider
1. Vattenlösliga basiska oxider reagerar med vatten och bildar baser: Na2O + H2O → 2NaOH. 2. Interagera med sura oxider, vilket orsakar
Kemiska egenskaper hos sura oxider
1. Reagera med vatten för att bilda en syra: SO3 + H2O → H2SO4. Men inte alla sura oxider reagerar direkt med vatten (SiO
Kemiska egenskaper hos amfotera oxider
1. Reagera med syror och bildar salt och vatten: ZnO + 2HCl → ZnCl2 + H2O. 2. Reagera med fasta alkalier (under fusion), vilket resulterar i bildningen
Grunder. Kemiska egenskaper hos baser. Amfotera tillstånd, reaktioner av deras interaktion med syror och alkalier
En bas är en kemisk förening som kan bilda en kovalent bindning med en proton (Brønsted-bas
Karakteristiska reaktioner
Amfotera oxider reagerar med starka syror och bildar salter av dessa syror. Sådana reaktioner är en manifestation av de grundläggande egenskaperna hos amfotära oxider, till exempel: ZnO + H2SO4
Syror. Anoxiska och syrehaltiga syror. Egenskaper hos syror (svavelsyra, saltsyra, salpetersyra)
Syror är komplexa ämnen vars molekyler består av utbytbara väteatomer och sura rester. Syraresten har en negativ laddning.
Svavelsyra
Svavelsyra H2SO4 är en stark tvåbasisk syra som motsvarar svavelets högsta oxidationstillstånd (+6). Under normala förhållanden, koncentrerad svavelsyra
Nitrater
Salpetersyra är en stark syra. Dess salter - nitrater - erhålls genom inverkan av HNO3 på metaller, oxider, hydroxider eller karbonater. Alla nitrater är mycket lösliga i vatten. Nitratjon i
Homogen katalys
Ett exempel på homogen katalys är nedbrytningen av väteperoxid i närvaro av jodjoner. Reaktionen sker i två steg: H2O2 + I → H2O + IO
Heterogen katalys
Vid heterogen katalys sker accelerationen av processen vanligtvis på ytan av en fast kropp - katalysatorn, därför beror katalysatorns aktivitet på storleken och egenskaperna hos dess yta. I praktiken
Effekten av koncentration på hastigheten av en kemisk reaktion. Massaktionens lag
För att ämnen ska reagera måste deras molekyler kollidera. Sannolikheten för att två personer kolliderar på en trafikerad gata är mycket högre än på en öde. Samma sak med molekyler. Det är uppenbart att i
Temperaturens inverkan på hastigheten av en kemisk reaktion. Aktiverings energi
Temperaturens inverkan på antalet molekylära kollisioner kan visas med hjälp av en modell. Till en första approximation bestäms temperaturens inverkan på reaktionshastigheten av van't Hoff-regeln (formulerad
Reaktioner utan och med deltagande av elektroner. Jonbyte och redoxreaktioner
Valenselektroner bestämmer beteendet hos ett kemiskt element i kemiska reaktioner. Ju färre valenselektroner ett grundämne har, desto lättare ger det upp dessa elektroner (det uppvisar egenskaperna att reducera
Bild av jonbytesreaktioner
En utbytesreaktion i en lösning representeras vanligtvis av tre ekvationer: molekylär, fulljonisk och förkortad jonisk. I joniska ekvationen representeras svaga elektrolyter, gaser och svårlösliga ämnen av m
Regler för att skriva jonbytesreaktioner
När du skriver joniska ekvationer bör du se till att följa tabellen över löslighet av syror, baser och salter i vatten, det vill säga se till att kontrollera lösligheten av reagenserna och produkterna
Oxidation
Oxidation är processen att förlora elektroner, med en ökning av graden av oxidation. När ett ämne oxideras ökar dess oxidationstillstånd som ett resultat av förlusten av elektroner. På
Återhämtning
Reduktion är processen att lägga till elektroner till en atom av ett ämne, medan dess oxidationstillstånd minskar. När jag reducerar atomer eller joner lägger jag till
Redox par
Ett oxidationsmedel och dess reducerade form, eller ett reduktionsmedel och dess oxiderade form utgör ett konjugerat redoxpar, och deras omvandlingar är oxidation-in
Typer av redoxreaktioner
Intermolekylära - reaktioner där oxiderande och reducerande atomer finns i molekyler av olika ämnen, till exempel: H2S + Cl2 → S + 2HCl Int.
Oxidation reduktion
I redoxreaktioner överförs elektroner från en atom, molekyl eller jon till en annan. Processen att förlora elektroner är oxidation. Under oxidation ökar oxidationstillståndet:
Interaktion med enkla ämnen
Interaktion med metaller: 2Na + Cl2 = 2NaCl, Fe + S = FeS, 6Li + N2 = 2Li3N, 2Ca + O2
Massfraktion
Massfraktion är förhållandet mellan massan av det lösta ämnet och lösningens massa. Massfraktion mäts i bråkdelar av en enhet eller i procent:
Molalitet (molviktskoncentration, molkoncentration)
Molalitet är mängden löst ämne (antal mol) i 1000 g lösningsmedel. Mätt i mol per kg är uttrycket "molalitet" också vanligt. Så, en lösning med koncentrationen 0.
Lösningstiter
Huvudartikel: Lösningstiter Lösningstiter är massan av det lösta ämnet i 1 ml lösning.
Löslighet. Jämvikt i heterogena system. Produkt av löslighet av svårlösliga oorganiska ämnen
Löslighet är ett ämnes förmåga att bilda homogena system med andra ämnen - lösningar där ämnet finns i form av enskilda atomer, joner, molekyler eller
Vattenlösningar av elektrolyter. Starka och svaga elektrolyter. Konstant och grad av dissociation. Ostwalds utspädningslag
LÖSNINGAR AV ELEKTROLYTER LÖSNINGAR AV ELEKTROLYTER innehåller märkbara koncentrationer av joner-katjoner och anjoner som bildas som ett resultat av elektrolytisk dissociation
Vatten pH
För enkelhetens skull uttrycks koncentrationerna som pH och hydroxyl-pH.
Dissociation av starka elektrolyter. Aktivitet av joner i lösningar. Aktivitetskoefficient. Förstå lösningens jonstyrka
Starka elektrolyter är kemiska föreningar vars molekyler i utspädda lösningar nästan helt dissocieras till joner. Graden av dissociation av sådana elektrolyter är nära
Grad av hydrolys
Graden av hydrolys avser förhållandet mellan den del av saltet som genomgår hydrolys och den totala koncentrationen av dess joner i lösning. Betecknad a (eller hhydr);
Elektrodpotential. Uppkomsten av ett potentiellt hopp vid interfasgränsen. Väteelektrod. Standard väteelektrod
Elektrodpotential är skillnaden i elektrisk potential mellan elektroden och elektrolyten i kontakt med den (oftast mellan en metall och en elektrolytlösning
Elektrokemisk korrosion av metaller i olika miljöer
Kontaktbimetallisk korrosion är en typ av elektrokemisk korrosion som orsakas av kontakt av metaller med olika elektrodpotentialer i elektrolyten. Samtidigt metallkorrosion
Kemisk interaktion av metaller med lösningar av vanliga syror och oxiderande syror
Saltsyra är det tekniska namnet för saltsyra. Det erhålls genom att lösa klorvätegas – HCl – i vatten. På grund av dess låga löslighet i vatten kan koncentrationen med
Späd svavelsyra
I en utspädd vattenlösning av svavelsyra dissocierar de flesta av dess molekyler: H2SO4
Koncentrerad svavelsyra
I en koncentrerad lösning av svavelsyra (över 68%) är de flesta av molekylerna i ett icke-dissocierat tillstånd, så svavel fungerar som ett oxidationsmedel
Elektrolysprocess. Katod- och anodprocesser. Ordningen för partikelurladdning vid anoden och katoden beroende på värdet på deras elektrodpotential
Elektrolys är en fysikalisk och kemisk process som består av frisättning på elektroder av beståndsdelar av lösta ämnen eller andra ämnen som härrör från sekundära
Katodreaktioner
Den sista reaktionen fortsätter med utvecklingen av väte. När elek
Matematisk syn
Faradays lagar kan skrivas som följande formel: där:
Konfiguration av atomer och joner
Lösligheten av salter och hydroxider av katjoner, som ligger till grund för den analytiska klassificeringen, liksom alla andra egenskaper hos katjoner, är funktionellt relaterad till positionen för motsvarande grundämnen i den periodiska cykeln.
Typer av titrering
Det finns direkta, omvända och substituent titreringar. Under direkttitrering till en lösning av analyten (alikvot eller prov, titrerad substans) d
Typer av titrimetrisk analys
Titrimetrisk analys kan baseras på olika typer av kemiska reaktioner: syra-bastitrering - neutraliseringsreaktioner; redoxtitrar
Ekvivalent molmassa av ett ämne
Molekvivalenter skrivs vanligtvis som eller
Ekvivalensnummer
Ekvivalenstalet z är ett litet positivt heltal lika med antalet ekvivalenter av ett ämne som finns i 1 mol av det ämnet. Faktor ekvivalent
Funktioner i strukturen av kolatomen. Oorganiska kolföreningar (oxider, karbonater och bikarbonater, karbider) och deras egenskaper
Kol är grunden för organiska och bioorganiska föreningar och många polymerer. De flesta kolföreningar tillhör organiska ämnen, men i detta arbete kommer vi att uppmärksamma
Dissociation av vatten. Vätgasindikator.
I Oda är en mycket svag elektrolyt. (Elektrolyt är ett ämne vars lösning eller smälta leder elektrisk ström). Vatten dissocierar (bryts upp) till dess beståndsdelar joner:
H 2 O ↔ H + + OH -
Jonisk produkt av vatten K W = [H+] · [OH-] = 10-14 = konst (molkoncentrationen av joner mol/l anges vanligtvis inom hakparenteser). I praktiken används väteindex för att bestämma miljön. Väteexponent negativ decimallogaritm för molkoncentrationen av vätejoner: pH= - log [H + ] och är inom 0<рН<14
|
Joner i lösning |
onsdag |
pH |
|
[H + ] > [OH - ] |
Sur |
pH< 7 |
|
[H+] = [OH-] = 10-7 mol/l |
Neutral |
pH = - log [ H + ] = - log 10 -7 = - (- 7) = 7 |
|
[OH - ] > [H + ] |
Alkalisk |
pH > 7 |
|
Var |
pH |
Var |
pH |
|
mage |
Regn |
5,5-6,5 |
|
|
tarmar |
8,5 - 9 |
Kranvatten |
6-6,5-7 |
|
läder |
5,5 -6 |
Havsvatten |
8-8,5 |
|
blod |
7,35-7,45 |
Jorden |
4-10 |
Hydrolys
Samspelet mellan saltjoner och vattenjoner, som ändrar pH-värdet, kallas hydrolys. Detta är en reversibel reaktion.
Om pH-värdet inte ändras när saltet löses upp (pH = 7 kvarstår), så sker ingen hydrolys.
Närvaron av en svag jon i saltet orsakar hydrolys - det är den svaga jonen som fäster till sig den motsatt laddade vattenjonen och bildar därigenom ny partikel (med eller utan laddning), och den återstående vattenjonen organiserar mediet: H+ - sur, OH - - alkalisk.
Starka elektrolyter.
|
Starka syror |
Starka grunder |
|
HCl ↔ H+ + Cl- |
NaOH↔ Na + + OH - |
|
H 2 SO 4 ↔ 2 H + + SO 4 2− |
KOH↔ K + + OH − |
|
HNO3 ↔ H + + NO3 - |
Om det inte finns någon partikel i tabellen, så kommer det att vara det svag partikel (svag jon).
Ett salt består av en katjon (positiv jon) och en anjon (negativ jon):
Jag + n K.O. -n (syrarester)
Det finns 4 möjliga saltkombinationer: 1. stark + och stark −
2. stark + och svag −
3. svag + och stark −
4.svag + och svag −
Låt oss överväga reaktioner med följande jonvariationer:
1. NaCl + H2O det finns ingen hydrolys, eftersom det inte finns någon svag partikel i saltet och pH-värdet ändras inte (lika med 7)
stark+stark
reaktionen är neutral och går dissociation till joner: NaCl + H 2 O ↔ Na + + Cl − + H 2 O
2. hydrolys av soda (teknisk)
Na2CO3 + H2O ↔
Stark+svag
CO 3 2− + H + OH - ↔ H + CO 3 2− − + OH - alkalisk miljö, pH>7, måste du skriva vidare i molekylär form
Na 2 CO 3 + H 2 O ↔ Na + H + CO 3 2− O + Na + OH - O
3. Hydrolys av zinksulfat
ZnSO4 + H2O ↔
Svag+stark
Zn +2 + H + OH - ↔ Zn +2 OH - + + H+ sur miljö, pH<7, нужно далее написать в молекулярном виде
2 ZnSO 4 + 2 H 2 O ↔ (Zn + 2 OH - ) + 2 SO 4 2- O + H 2 + SO 4 2- O
4. Hydrolysen av aluminiumkarbonat fortsätter till fullbordan, eftersom saltet består av två svaga partiklar.
Al 2 (С O 3 ) 3 + 6H 2 O ↔ 2Al(OH) 3 + 3H 2 CO 3
Elektrokemi
Om en metallplatta placeras i en lösning av dess salt, bildas ett dubbelt elektriskt skikt vid gränsen mellan de fasta och flytande faserna, vars värde uppskattas av värdet på elektrodpotentialen φ. För många metaller bestäms elektrodpotentialerna med hjälp av en väteelektrod, vars potential antas vara noll φ=0. Elektrodpotentialdata presenteras i tabell nr 3 i bilagan i metod 4/23/2 "Arbetsprogram och uppgift för testet".
Standardelektrodpotentialer ( 0 )
vissa metaller (spänningsområde) vid 298K.
|
Elektrod halvreaktion |
Elektrod halvreaktion |
||
|
Li + (aq.) + 1 e - = Li (sol.) |
3.045 |
Cd 2+ (aq) + 2 e - = Cd (sol) |
0.403 |
|
Rb + (aq) + 1 e - = Rb (sol) |
2.925 |
Co 2+ (aq) + 2e - = Co (sol) |
0.277 |
|
K + (aq) + 1 e - = K (sol) |
2.924 |
Ni 2+ (aq) + 2 e - = Ni (sol) |
0.250 |
|
Cs + (aq.) + 1 e - = Cs (sol.) |
2.923 |
Sn 2+ (aq) + 2 e - = Sn (sol) |
0.136 |
|
Ba 2+ (aq) + 2 e - = Ba (sol) |
2.905 |
Pb 2+ (aq.) + 2 e - = Pb (sol.) |
0.126 |
|
Ca 2+ (aq) + 2 e - = Ca (sol) |
2.866 |
Fe 3+ (aq.) + 3 e - = Fe (sol.) |
0.037 |
|
Na + (aq.) + e - = Na (sol.) |
2.714 |
2H+ (aq) + 2e- = H2 (g) |
0.000 |
|
Mg 2+ (aq) + 2 e - = Mg (sol) |
2.363 |
Sb 3+ (aq.) + 3 e - = Sb (sol.) |
0.200 |
|
Al 3+ (aq.) + 3 e - = Al (sol.) |
1.663 |
Bi 3+ (aq.) + 3 e - = Bi (sol.) |
0.215 |
|
Ti 2+ (aq) + 2 e - = Ti (sol) |
1.630 |
Cu 2+ (aq.) + 2 e - = Cu (sol.) |
0.337 |
|
Zr 4+ (aq.) + 4 e- = Zr (sol.) |
1.539 |
Cu + (aq) + e - = Cu (sol) |
0.520 |
|
Mn 2+ (aq.) + 2 e - = Mn (sol.) |
1.179 |
Ag + (aq.) + e - = Ag (sol.) |
0.799 |
|
V 2+ (aq.) + 2 e - = V (sol.) |
1.175 |
Hg 2+ (aq) + 2 e - = Hg (l) |
0.850 |
|
Cr 2+ (aq) + 2 e - = Cr (sol) |
0.913 |
Pd 2+ (aq) + 2 e - = Pd (sol) |
0,987 |
|
Zn 2+ (aq.) + 2 e - = Zn (sol.) |
0.763 |
Pt 2+ (aq) + 2 e - = Pt (sol) |
1,188 |
|
Cr3+ (aq.) + 3 e - = Cr (sol.) |
0.744 |
Au 3+ (aq.) + 3 e - = Au (sol.) |
1,498 |
|
Fe 2+ (aq) + 2 e - = Fe (sol) |
0.440 |
Au + (aq.) + e - = Au (sol.) |
1,692 |
Elektrodpotentialer med ett minustecken hänvisar till de metaller som tränger undan väte från syror. I rubriken på tabellen motsvarar "Standardelektrodpotentialer" de potentialer som bestämts under standardförhållanden: temperatur t =25°C (T = 298 K), tryck P = 1 atm, koncentration av lösningen som elektroden är nedsänkt i C = 1 mol/l. φ 0 --- st. konventionell
Ju lägre elektrodpotential φ, desto mer aktiv metall, desto större reduktionsmedel är den.
Exempel . Vilken metall är mer aktiv, zink eller aluminium? Svar: Aluminium, eftersom dess potential (enligt tabell nr 3) är mindre än zink.
Galvaniska element.
En galvanisk cell (GC) är en anordning där energin från en kemisk reaktion direkt omvandlas till elektrisk energi. GE består av sammankopplade metallelektroder nedsänkta i lösningar av deras salt. Metallplattorna är anslutna via en indikeringsanordning. Halvcellerna är anslutna till en elektrisk krets med hjälp av ett rör fyllt med en ledande lösning (den så kallade saltbryggan). I fig. 1. ett diagram över en galvanisk koppar-zinkcell (Jacobi-Daniel) visas. − Zn/Zn2+//Cu2+/Cu+
Zn Cu
- +
ZnSO4 CuSO4
Ris. 1. Diagram av en galvanisk cell: 1 - elektrod (Zn); 2-kärl med ZnSO-lösning 4 ; 3 - saltbro; 4-kärl med CuSO-lösning 4; 5-elektrod (Ci).
Vi skriver ner värdena på elektrodpotentialer för zink och koppar från tabell nr 3:
0 = 0,337 V 0 = −0,763 V
Cu 2+ / Cu 0 Zn 2+ / Zn 0
En metall med en lägre elektrodpotential övervägs anoden och den oxiderar.
Vi ser att det potentiella värdet för zink är mindre än för koppar, vi drar slutsatsen att zink
anod (fungerar som en negativ elektrod) A Zn 0 - 2ē Zn 2+
Metallen som har en högre elektrodpotential anses vara atom och han håller på att återställas.
Reaktionen vid höger elektrod för koppar, eftersom det är katoden (fungerar som en positiv elektrod), motsvarar reduktionsprocessen:
K Cu 2+ + 2ē Cu 0
Galvaniska celler representeras av följande notation:
− Zn 0 / ZnSO 4 / / CuSO 4 / Cu 0 + eller i jonform: − Zn 0 / Zn 2+ / / Cu 2+ / Cu 0
där de vertikala linjerna symboliserar metalllösningsgränsen och den dubbla linjen symboliserar gränsen mellan elektrolytlösningar.
Jobb GE bedöms utifrån värdet av dess E.M.F. (den högsta spänningen som GE kan producera). EMF för en galvanisk cell är skillnaden mellan elektrodpotentialerna för oxidatorn och reduceraren, det vill säga den är lika med skillnaden mellan elektrodpotentialerna för katoden och anoden.
E = K 0 − A 0 (1) E-teor = K beräknad − A beräknad
Elektrodpotentialen hos en metall beror på koncentrationen av dess joner i lösning.
Detta beroende uttrycks av Nernst-ekvationen:
var - standardmetallpotential, R - universell gaskonstant, T - absolut temperatur, n - tal arbetande elektroner , som går från anod till katod, F - Faraday nummer 1 F = 96500 C, C - koncentration av metalljoner.
Om vi i ovanstående ekvation ersätter konstanterna R och F med deras numeriska värden och den naturliga logaritmen med en decimal, kommer den att ha följande form:
Om koncentrationerna av lösningar vid elektroderna inte är desamma, beräkna först nya potentialvärden för katoden och anoden, korrigerade för koncentration enligt Nernst-ekvationen, och ersätt dem sedan i ekvation (1).
Koncentration galvanisk cell (CGE)består av två plattor av samma metall nedsänkta i lösningar av dess salt, som endast skiljer sig åt i koncentration. − Zn 0 / Zn 2+ / / Zn 2+ / Zn 0 +
Zn Zn
- +
ZnSO 4 Zn SO 4
C1C2 Ris. 2. Diagram av en galvanisk cell: 1,5 - elektroder (Zn); 2, 4 - kärl med ZnSO-lösning 4 ; 3 - saltbro.
En elektrod som är nedsänkt i en lösning medlägre koncentration anses vara en anod.
Låt oss säga C 1< С 2 , då är den vänstra elektroden 1 anoden och den högra elektroden 2 kommer att vara katoden. CGE fungerar tills koncentrationerna av C planar ut. 1 = C 2.
Metallkorrosion
Detta är förstörelse (oxidation) av metaller under påverkan av miljön.
Polarisering bromsa korrosion på grund av bildandet på metallytan av: 1) en tunn film osynlig för ögat, vilket förhindrar ytterligare penetration av oxidationsmedlet; Jag har en sådan film Al, Ti, Zn, Sn, Pb, Mn, Cd, Tl.
2) ett tjockt lager av korrosionsprodukter (synligt), vilket gör det svårt att närma sig själva metallen. I detta fall beror graden av polarisering på porositeten hos detta skikt. Till exempel har grön patina på koppar sammansättningen ( CuOH) 2 CO 3 och dess porositet är mindre än för järn (produkten är rost Fe2O3nH2O ), därför skyddar patina koppar bättre än rostskydd järn.
Avpolarisering acceleration av korrosion. Det finns väte och syre.
1) Vätedepolariseringförekommer i sura miljöer (utspädda syror HCl, H2SO4, HNO3 etc.). Under elektrokemisk korrosion, eftersom legerande metalltillsatser införs i många metaller och mikrogalvaniska celler bildas på grund av potentialskillnader, återställs miljön vid katoden, det vill säga väte reduceras från syran:
K 2Н + + 2ē Í 0 2,
och på anoden A metalloxidation.
2) Syre depolariseringförekommer i neutrala och svagt alkaliska miljöer (vi överväger atmosfärisk korrosion)
K 2H 2 O + + O 2 + 4ē 4OH − ,
A Fe 0 - 2ē Fe 2+ oxidation av järn till Fe 2+ i början av korrosion, först då, med tiden, uppstår oxidation Fe3+.
Korrosionsprodukt Fe (OH) 2 + O 2 → Fe (OH) 3 eller Fe 2 O 3 · nH 2 O brun råg.
SLUTSATS: korrosion (oxidation) av en metall är alltid en anodprocess, och mediet återställs vid katoden.
Många koncentrerade syror passivisera (blockera, kraftigt minska korrosionshastigheten) många metaller. Så här passiverar koncentrerad svavelsyra järn: en tät tunn film bildas på ytan FeSO4 , vilket förhindrar inträngning av svavelsyra.
pH-värdets inverkan på korrosionshastigheten.
Diagram 1 för metaller Al, Zn, Sn, Pb . Dessa metaller är stabila i en neutral miljö på grund av amfotericitet (de står mellan äkta metaller och icke-metaller i det periodiska systemet) och korrosionsprodukter reagerar med både syror och alkalier. Således är det nödvändigt att förbereda vatten för att arbeta med aluminiumvärmeväxlare (korrigering: Al stabil vid pH=7; Pb vid pH=8; Sn vid pH=9; kurvans natur är densamma).
hastighet V KOR
korrosion
V KOR
| |
0 7 pH 0 7 pH
Diagram 1. Diagram 2.
Diagram 2 visar kurvan för körtel: den är stabil i mycket alkaliska miljöer.
Metoder för att skydda metaller från korrosion.
- Legeringmetaller införande av metalltillsatser i basmetallen för att erhålla nya egenskaper: a) ökad hårdhet räls, hjulMn, W, Zn, Cr, Moetc.; b) ökad korrosionsbeständighet olika typer av rostfritt stål; c) utseendet av plasticitet och mjukhet; d) ferromagnetiska egenskaper.
- Introduktionkorrosionsinhibitorerämnen som minskar miljöpåverkan: syreabsorbenter i lösningNa2 SÅ3 ; katodiska moderatorer bildar en film på metallen (kromater, bikromaterK2 Cr2 O7 nitriter, etc.); För sura miljöer används organiska föreningar (katapin).
- Icke-metalliska beläggningar: lacker, färger, smörjmedel, vaxer, pastor, polymerer, gummin, hårdgummi. Skydd med gummi och ebonit kallas gummining.
- Elektrokemiskt skydd:A)metallbeläggningar; b) slitbaneskydd; c) katodiskt skydd.
- Strömskydd: Man tror att 50 % av korrosionen i järnvägstransporter uppstår på grund av ströströmmar, alla delar av rullande materiel och det som finns i marken påverkas. Tanken med skydd är att avleda en del av strömmarna genom styrningar i marken, som är anslutna till en diod, som organiserar strömpassagen i en riktning (sug).
- Försvar frånmikrobiologisk korrosion: polymerbaserade lacker och färger, luftväxling, temperaturförhållanden inte högre än 200 C och luftfuktighet högst 80%, konserveringsmedel med inhibitorer, offer- och katodskydd.

Slitbana skydd:jag- Stål struktur,Katodiskt skydd:jag- belagt rör,
2- skydd, 3- fyllmedel, 4- elektriska 2- anslutningstrådar, 3- källor
kontakt med struktur, 5 kontroll DC, 4 anoder.
mätterminal (jagPZSkyddsström Mekanism: elektrolys
skydd). Mekanism: GE
Påtrampa(anodisk) elektrokemiskt skydd, ett skydd är fäst på den skyddade metallstrukturen - metall medmer negativt värde på elektrodpotentialen. Aktiviteten hos den metall som valts som skydd kan bedömas genom skyddets verkansradie, dvs. det avstånd över vilket verkan av den valda metallen sträcker sig. För slitbanan skydd av stål används oftast zink, liksom aluminium, kadmium och magnesium. Slitbaneskyddets radie är cirka 50 m.
Vid skydd av kablar, rörledningar och andra konstruktioner i marken installeras zinkskydd i en fyllmedelssammansättning: 25% CaSO4 2H2 Åh, 28% Na2 SÅ4 · 10 N2 Åh, 50% lera. Skydd för installation i marken är vanligtvis gjorda i form av cylindrar. För kontakt med anslutningstråden, som vanligtvis är lödd, har skyddet en galvaniserad stålkärna.
Korrosionshastigheten med anodskydd kan reduceras till ett minimivärde som motsvarar den fulla polarisationsströmmen, men reduceras aldrig till noll, som i fallet med katodskydd.
Katodelektrokemiskt skydd används för att skydda metallprodukter som finns i marken. Det utförs genom att ansluta metallstrukturer till den negativa polen på en extern likströmskälla. Med katodiskt skyddOlösliga material (grafit, kol) eller upplösande metallskrot (skenor, gamla rör) används som hjälpelektrod (anod), som måste förnyas med jämna mellanrum. Vid bekämpning av underjordisk korrosion är den positiva polen på den externa strömkällan jordad. Räckvidden för katodiskt skydd är cirka 2 km.

Strömskydd: jaglikriktarstation, 2- kontaktnät, 3- skenor, 4- jord, 5- ströström, 6- rörledning, 7- diod, 8- metallbygel.
För att skydda underjordiska metallkonstruktioner från förstörelse av ströströmmar används denelektriskt avloppsskydd. Det utförs genom att ansluta anodsektionen av en underjordisk struktur (rör) med en metallledare till en källa för ströströmmar, till exempel en skena. Strömmen passerar genom metallledaren, vilket resulterar i att jordskenans potentialskillnad elimineras, och därmed risken för korrosion. Eftersom strömmen på elektrifierade järnvägar ofta kan ändra sin riktning, används polariserad elektrisk dränering för större tillförlitlighet i skyddet. För att göra detta ingår en likriktare, till exempel en kisel- eller germaniumdiod, i metallanslutningarna, vilket säkerställer att ström bara flyter i önskad riktning.
ELEKTROLYS
Detta är omvandlingen av ett ämne under påverkan av elektrisk ström. Samtidigt påkatodhåller på att återställaspositiva partiklar (katjoner), och igenanodoxideranegativa partiklar (anjoner).
Används vid elektrolyslöslig(metall) ocholöslig(kol)elektroder.Elektrodlöslighet är endast viktig för den anodiska processen. Som standard används kolelektroder.
Faradays första lag.
När en mängd elektricitet leds genom en lösning eller smälta av ett ämne 1F= 96500 C, en ekvivalent elektrolysprodukter frigörs vid katoden och anoden.
Faradays andra lag.
Massan eller volymen av elektrolysprodukten beror direkt på strömstyrkan, tiden för elektricitetens passage och elektrolysproduktens natur.
Och,
Varjag strömstyrkaA;t tid, s; Edriva massekvivalent, G;EVdriva volymetrisk ekvivalent, l.Aktuell utgång
Elektrolys kännetecknas av hög strömverkningsgrad: 97-99%.
Elektrolys används för framställning av ämnen med hög renhet, metaller, för beläggning, galvanisering, elektroformning, separation av blandningar av ämnen, för elektrokoagulering, för framställning av väte som alternativt bränsle, för katodiskt korrosionsskydd, etc.
Regler för att skriva elektrolysekvationer för vattenlösningar.
- Reduktion av katjoner vid katoden.
a) Om saltmetallen är i "spänningsserien" upp tillAlinklusive, då reduceras väte från vatten vid katoden, och metallen förblir i lösning:
TILL2H+ + 2ē → N0 2
b) Om saltmetallen är i "spänningsserien" frånTiupp till H inklusive, då reduceras både väte från vatten och metall vid katoden:
TILL2H+ + 2ē → N0 2 OchCr3+ + 3ē →Cr0
V)Om saltmetallen är i "spänningsserien" efter väte, reduceras en metall vid katoden:
TILLAg+ + 1 ē → Ag0
- Oxidation av anjoner vid anoden
A)för olösliga (kol)elektroder:
S2- , jag- , Br - Cl- ÅH- ,NEJ3 - , SÅ4 2- , P.O.4 3-
ökande svårighet för anjonoxidation.
b)för lösliga (metall)elektroder:
saltanjonerna förblir i lösning, ochlösligt metallanodmaterial oxiderar.
SIDAN 7
katjon+
anjon −
Den joniska produkten av vatten är produkten av koncentrationerna av vätejoner H+ och hydroxidjoner OH? i vatten eller i vattenlösningar, vatten autoprotolys konstant. Visar värdet av den joniska produkten av vatten
Vatten, även om det är en svag elektrolyt, dissocierar i liten utsträckning:
H2O + H2O - H3O+ + OH? eller H2O - H+ + OH?
Jämvikten i denna reaktion är starkt förskjuten åt vänster. Dissociationskonstanten för vatten kan beräknas med formeln:
Koncentration av hydroniumjoner (protoner);
Hydroxidjonkoncentration;
Koncentration av vatten (i molekylär form) i vatten;
Koncentrationen av vatten i vatten, med hänsyn till dess låga dissociationsgrad, är praktiskt taget konstant och uppgår till (1000 g/l)/(18 g/mol) = 55,56 mol/l.
Vid 25 °C är dissociationskonstanten för vatten 1,8×10×16 mol/l. Ekvation (1) kan skrivas om som: Låt oss beteckna produkten K· = Kw = 1,8×10?16 mol/l · 55,56 mol/l = 10?14mol/l = · (vid 25 °C).
Konstanten Kw, lika med produkten av koncentrationerna av protoner och hydroxidjoner, kallas den joniska produkten av vatten. Det är konstant inte bara för rent vatten, utan också för utspädda vattenlösningar av ämnen. Med ökande temperatur ökar dissociationen av vatten, därför ökar också Kw; med sjunkande temperatur, vice versa. Den praktiska betydelsen av den joniska produkten av vatten
Den praktiska betydelsen av den joniska produkten av vatten är stor, eftersom den gör det möjligt att, med en känd surhet (alkalinitet) för vilken lösning som helst (det vill säga vid en känd koncentration eller ), hitta motsvarande koncentration eller . Även om de i de flesta fall, för att underlätta presentationen, inte använder absoluta koncentrationsvärden, utan deras decimallogaritmer tagna med motsatt tecken - respektive väteindex (pH) och hydroxylindex (pOH).
Eftersom Kb är en konstant, när syra (H+ joner) tillsätts till en lösning, koncentrationen av hydroxidjoner OH? kommer att falla och vice versa. I en neutral miljö = = mol/l. Vid en koncentration > 10-7 mol/l (respektive koncentrationen< 10?7 моль/л) среда будет кислой; При концентрации >10-7 mol/l (respektive koncentration< 10?7 моль/л) -- щелочной.
Elektrolytisk dissociation av vatten. PH värde
Vatten är en svag amfotär elektrolyt:
H2O H+ + OH- eller mer exakt: 2H2O H3O+ + OH-
Dissociationskonstanten för vatten vid 25°C är lika med: Detta värde på konstanten motsvarar dissociationen av en av hundra miljoner vattenmolekyler, därför kan koncentrationen av vatten anses vara konstant och lika med 55,55 mol/l (densitet) vatten 1000 g/l, massa 1 liter 1000 g, mängd vattensubstans 1000g: 18g/mol=55,55 mol, C=55,55 mol: 1 l = 55,55 mol/l). Sedan
Detta värde är konstant vid en given temperatur (25°C), det kallas den joniska produkten av vatten KW:
Dissociationen av vatten är en endoterm process, därför, med ökande temperatur, i enlighet med Le Chateliers princip, intensifieras dissociationen, den joniska produkten ökar och når ett värde på 10-13 vid 100°C.
I rent vatten vid 25°C är koncentrationerna av väte och hydroxyljoner lika:
10-7 mol/l Lösningar där koncentrationerna av väte och hydroxyljoner är lika kallas neutrala. Om en syra tillsätts rent vatten kommer koncentrationen av vätejoner att öka och bli större än 10-7 mol/l, mediet blir surt och koncentrationen av hydroxyljoner kommer omedelbart att ändras så att den joniska produkten av vatten behåller dess värde på 10-14. Samma sak kommer att hända när man tillsätter alkali till rent vatten. Koncentrationerna av väte- och hydroxyljoner är relaterade till varandra genom jonprodukten, därför är det lätt att beräkna koncentrationen av den andra när man känner till koncentrationen av en av jonerna. Till exempel, om = 10-3 mol/l, då = KW/ = 10-14/10-3 = 10-11 mol/l, eller om = 10-2 mol/l, då = KW/ = 10-14 /10-2 = 10-12 mol/l. Sålunda kan koncentrationen av väte eller hydroxyljoner tjäna som en kvantitativ egenskap för surheten eller alkaliniteten hos mediet.
I praktiken använder de inte koncentrationerna av väte eller hydroxyljoner, utan väte-pH- eller hydroxyl-pOH-indikatorerna. Väte-pH-indikatorn är lika med den negativa decimallogaritmen för koncentrationen av vätejoner:
Hydroxylindexet pOH är lika med den negativa decimallogaritmen för koncentrationen av hydroxyljoner:
pOH = - log
Det är lätt att visa genom att ta logaritmen för den joniska produkten av vatten att
pH + pH = 14
Om miljöns pH är 7 är miljön neutral, om den är lägre än 7 är den sur och ju lägre pH desto högre koncentration av vätejoner. pH högre än 7 betyder att miljön är alkalisk; ju högre pH, desto högre koncentration av hydroxyljoner. Rent vatten leder elektricitet mycket dåligt, men har fortfarande mätbar elektrisk ledningsförmåga, vilket förklaras av den lätta dissociationen av vatten till vätejoner och hydroxidjoner. Baserat på rent vattens elektriska ledningsförmåga kan koncentrationen av väte- och hydroxidjoner i vatten bestämmas.
Eftersom graden av dissociation av vatten är mycket liten, är koncentrationen av odissocierade molekyler i vatten praktiskt taget lika med den totala koncentrationen av vatten, därför, från uttrycket för vattens dissociationskonstanten, hälften av det för vatten och utspädd vattenhaltig lösningar vid konstant temperatur är produkten av koncentrationerna av vätejoner och hydroxidjoner ett konstant värde. Denna konstant kallas den joniska produkten av vatten.
Lösningar där koncentrationerna av väte- och hydroxidjoner är desamma kallas neutrala. Sura lösningar innehåller fler vätejoner, medan alkaliska lösningar innehåller fler hydroxidjoner. Men produkten av deras koncentrationer är alltid konstant. Detta betyder att om koncentrationen av vätejoner i en vattenlösning är känd, så bestäms också koncentrationen av hydroxidjoner. Därför kan både surhetsgraden och graden av alkalinitet hos en lösning kvantitativt karakteriseras av koncentrationen av vätejoner:
Surheten eller alkaliniteten hos en lösning kan uttryckas på ett mer bekvämt sätt: istället för koncentrationen av vätejoner, ange dess decimallogaritm, taget med motsatt tecken. Det sista värdet kallas väteindex och betecknas pH:. Av detta är det tydligt att i en neutral lösning pH = 7; i sura lösningar pH<7 и тем меньше, чем кислее раствор; в щелочных растворах рН>7, och ju fler desto högre alkalinitet hos lösningen.
Det finns olika metoder för att mäta pH. Den ungefärliga reaktionen av en lösning kan bestämmas med hjälp av speciella reaktorer som kallas indikatorer, vars färg ändras beroende på koncentrationen av vätejoner. De vanligaste är metylorange, metylrött, fenolftalein och lackmus.