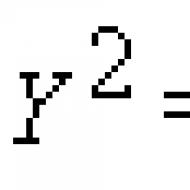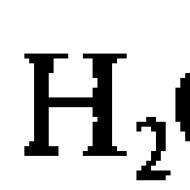Dysocjacja wody. wartość PH
Czysta woda, choć słabo (w porównaniu z roztworami elektrolitów), może przewodzić prąd elektryczny. Jest to spowodowane zdolnością cząsteczki wody do rozpadu (dysocjacji) na dwa jony, które w czystej wodzie są przewodnikami prądu elektrycznego (poniżej dysocjacja oznacza dysocjację elektrolityczną - rozkład na jony): H 2 O ↔ H + + OH -
Na około 556 000 000 niezdysocjowanych cząsteczek wody dysocjuje tylko 1 cząsteczka, ale jest to 60 000 000 000 zdysocjowanych cząsteczek w 1 mm3. Dysocjacja jest odwracalna, to znaczy jony H+ i OH - mogą ponownie utworzyć cząsteczkę wody. W rezultacie zachodzi równowaga dynamiczna, w której liczba rozpadających się cząsteczek jest równa liczbie powstałych jonów H + i OH -. Innymi słowy, prędkości obu procesów będą równe. W naszym przypadku równanie szybkości reakcji chemicznej można zapisać w następujący sposób:
υ 1 = κ 1 (dla dysocjacji wody)
υ 2 = κ 2 (dla procesu odwrotnego)
gdzie υ jest szybkością reakcji; κ jest stałą szybkości reakcji (zależną od rodzaju reagentów i temperatury); i - stężenia (mol/l).
W stanie równowagi υ 1 = υ 2 zatem: κ 1 = κ 2
Ponieważ w określonej temperaturze wielkości stosowane do obliczania iloczynu jonowego wody (K, ) są stałe, wartość iloczynu jonowego wody również jest stała. A ponieważ w wyniku dysocjacji cząsteczki wody powstaje taka sama liczba jonów i , okazuje się, że dla czystej wody stężenia i będą wynosić 10 -7 mol/l. Ze stałości produktu jonowego wody wynika, że jeśli liczba jonów H + staje się większa, to liczba jonów HO - maleje. Na przykład, jeśli do czystej wody doda się mocny kwas HCl, jako mocny elektrolit całkowicie rozdzieli się na H + i Cl -, w wyniku czego stężenie jonów H + gwałtownie wzrośnie, co doprowadzi do wzrost szybkości procesu przeciwnego do dysocjacji, ponieważ zależy to od stężenia jonów H + i OH -: υ 2 = κ 2
Podczas przyspieszonego procesu przeciwnego do dysocjacji stężenie jonów HO - zmniejszy się do wartości odpowiadającej nowej równowadze, przy której będzie ich na tyle mało, że szybkości dysocjacji wody i procesu odwrotnego znów będą równe. Jeżeli stężenie powstałego roztworu HCl wynosi 0,1 mol/l, stężenie równowagowe będzie wynosić: = 10 -14 /0,1 = 10 -13 mol/l
Produkt jonowy wodý jest iloczynem stężeń jonów wodorowych H + i jonów hydroksylowych OH – w wodzie lub roztworach wodnych, stała autoprotolizy wody.
Woda, mimo że jest słabym elektrolitem, w niewielkim stopniu dysocjuje:
Równowaga tej reakcji jest silnie przesunięta w lewo. Stałą dysocjacji wody można obliczyć ze wzoru:
· - stężenie jonów hydroniowych (protonów);
· - stężenie jonów wodorotlenkowych;
· - stężenie wody (w postaci molekularnej) w wodzie;
Stężenie wody w wodzie, biorąc pod uwagę jej niski stopień dysocjacji, jest praktycznie stałe i wynosi (1000 g/l)/(18 g/mol) = 55,56 mol/l.
W temperaturze 25 °C stała dysocjacji wody wynosi 1,8·10 −16 mol/l. Równanie (1) można przepisać jako:
Stała K w, równa iloczynowi stężeń protonów i jonów wodorotlenkowych, nazywana jest produktem jonowym wody. Jest stała nie tylko dla czystej wody, ale także dla rozcieńczonych wodnych roztworów substancji. Wraz ze wzrostem temperatury wzrasta dysocjacja wody, dlatego wzrasta również Kv, wraz ze spadkiem temperatury - odwrotnie. Praktyczne znaczenie produktu jonowego wody jest ogromne, ponieważ pozwala przy znanej kwasowości (zasadowości) dowolnego roztworu (to znaczy przy znanym stężeniu lub ) znaleźć odpowiednie stężenie lub . Chociaż w większości przypadków dla wygody prezentacji nie stosuje się wartości bezwzględnych stężeń, ale ich logarytmy dziesiętne przyjmowane z przeciwnym znakiem - odpowiednio wskaźnik wodorowy (pH) i wskaźnik hydroksylowy (pOH).
Ponieważ Kb jest stałą, po dodaniu do roztworu kwasu (jony H +) stężenie jonów wodorotlenkowych OH - spadnie i odwrotnie. W neutralnym środowisku = = mol/l. Przy stężeniu > 10 −7 mol/l (odpowiednio stężenie< 10 −7 моль/л) среда будет kwaśny; Przy stężeniu > 10 −7 mol/l (odpowiednio stężenie< 10 −7 моль/л) - alkaliczny.
27. Roztwory buforowe: ich skład, właściwości, mechanizm działania. Pojemność bufora
Roztwory buforowe- są to roztwory zawierające układy buforowe. Układy buforowe to mieszaniny zawierające słabe kwasy i ich sole z mocnymi zasadami lub słabe zasady i ich sole z mocnymi kwasami w określonym stosunku ilościowym. Roztwory takie charakteryzują się stabilnym stężeniem jonów H+ po rozcieńczeniu obojętnym rozpuszczalnikiem (wodą) i dodaniu do nich określonej ilości mocnych kwasów lub zasad.
Roztwory buforowe znajdują się w wodach oceanów świata, roztworach glebowych i organizmach żywych. Układy te pełnią funkcje regulatorów, które utrzymują aktywną reakcję środowiska na określonej wartości niezbędnej do pomyślnego zajścia reakcji metabolicznych. Roztwory buforowe dzielą się na kwaśne i zasadowe. Przykładem pierwszego byłby układ buforu octanowego, a przykładem drugiego byłby układ buforowy amonowy. Istnieją naturalne i sztuczne roztwory buforowe. Naturalnym roztworem buforowym jest krew, która zawiera układy buforujące wodorowęglany, fosforany, białka, hemoglobinę i kwasy. Sztucznym roztworem buforowym może być bufor octanowy składający się z CH3COOH.
Rozważmy cechy składu wewnętrznego i mechanizmu działania układów buforowych na przykładzie octanowego układu buforowego: kwas octanowy/octan sodu. W środowisku wodnym składniki układu buforowego ulegają dysocjacji elektrolitycznej. Octan sodu, jako sól słabego kwasu i mocnej zasady, całkowicie dysocjuje na jony. Obecność anionów w takiej mieszaninie buforowej zależy od stężenia w niej soli i stopnia jej dysocjacji. Stężenie jonów H+ w układzie buforowym jest wprost proporcjonalne do stężenia znajdującego się w nim kwasu i odwrotnie proporcjonalne do zawartości w nim soli tego kwasu.
Zatem stężenie jonów H+ w buforze głównym jest wprost proporcjonalne do stężenia w nim soli i odwrotnie proporcjonalne do stężenia zasady.
Na przykład konieczne jest przygotowanie buforu octanowego o kilku wartościach pH. Najpierw przygotuj 5M roztwory kwasu octanowego i octanu sodu. Aby przygotować pierwszy roztwór, weź 50 ml każdego składnika. Kierując się wzorem, określ stężenie jonów H+ w powstałym roztworze.
Do kolejnego roztworu buforowego należy pobrać 80 ml roztworu kwasu i 20 ml przygotowanego wcześniej roztworu soli. Istnieje wiele receptur różnych roztworów buforowych stosowanych w analizie chemicznej i praktyce laboratoryjnej.
Roztwory buforowe charakteryzują się określonymi właściwościami. Do nich należy przede wszystkim buforowanie – zdolność do utrzymania stałego stężenia jonów H+ w przypadku dodania do roztworu buforowego określonej ilości mocnego kwasu lub mocnej zasady. Na przykład, jeśli do buforu octanowego dodana zostanie niewielka ilość kwasu chlorkowego, pH nie przesunie się w stronę kwaśną, ponieważ kwas chlorkowy ulegnie reakcji rozkładu wymiennego z solą słabego kwasu. W wyniku reakcji mocny kwas, który może przesunąć pH w stronę kwaśną, zostaje zastąpiony słabym kwasem i obojętną solą. Stopień dysocjacji słabego roztworu elektrolitu maleje wraz ze wzrostem jego stężenia, dąży do zera i nie następuje zmiana pH.
Pojemność roztworu buforowego(z angielskiego bufor- amortyzator, angielski polerować- wstrząsy zmiękczające) - ilość kwasu lub zasady potrzebna do zmiany pH roztworu buforowego dokładnie o 1.
Mieszanka buforowa, roztwór buforowy, układ buforowy- połączenie substancji, system utrzymujący stałe pH.
Woda- słaby elektrolit amfoteryczny.
Równanie na jonizację wody uwzględniające uwodnienie jonów wodorowych H+ wygląda następująco:
Nie biorąc pod uwagę uwodnienia jonów H+, równanie dysocjacji wody ma postać:
![]()
Jak widać z drugiego równania, stężenia jonów wodorowych H + i jonów wodorotlenkowych OH - w wodzie są takie same. W 25 o C [H + ] = [OH - ] = 10 -7 mol/l.
Nazywa się iloczynem stężeń jonów wodorowych i jonów wodorotlenkowych jonowy produkt wody(KH2O).
K. H. 2 O = ∙
K H 2 O jest wartością stałą i w temperaturze 25 o C
K. H. 2 O = 10 -7 ∙10 -7 = 10 -14
W rozcieńczonych wodnych roztworach elektrolitów, podobnie jak w wodzie, iloczyn stężeń jonów wodorowych H + i jonów wodorotlenkowych OH - jest wartością stałą w danej temperaturze. Produkt jonowy wody umożliwia każdemu roztworowi wodnemu obliczenie stężenia jonów wodorotlenkowych OH - jeśli znane jest stężenie jonów wodorowych H + i odwrotnie.
Środowisko dowolnego roztworu wodnego można scharakteryzować stężeniem jonów wodorowych H + lub jonów wodorotlenkowych OH -.
W roztworach wodnych występują trzy rodzaje mediów: obojętne, zasadowe i kwaśne.
Neutralne środowisko to ośrodek, w którym stężenie jonów wodorowych jest równe stężeniu jonów wodorotlenkowych:
[H + ] = = 10-7 mol/l
Kwaśne środowisko to ośrodek, w którym stężenie jonów wodorowych jest większe od stężenia jonów wodorotlenkowych:
[H + ] > [OH - ], > 10 -7 mol/l
Środowisko alkaliczne to ośrodek, w którym stężenie jonów wodorowych jest mniejsze od stężenia jonów wodorotlenkowych:
< , < 10 -7 моль/л
Aby scharakteryzować środowiska roztworów, wygodnie jest zastosować tak zwaną wartość pH (pH).
wartość PH nazywa się ujemnym logarytmem dziesiętnym stężenia jonów wodorowych: pH = -log.
Na przykład, jeśli = 10 -3 mol/l, to pH = 3, środowisko roztworu jest kwaśne; jeśli [H + ] = 10 -12 mol/l, to pH = 12, środowisko roztworu jest zasadowe: 
Wartość pH jest mniejsza niż 7, im bardziej kwaśny jest roztwór. Wartość pH jest większa niż 7, tym większa jest zasadowość roztworu.
Zależność pomiędzy stężeniem jonów H+, wartością pH i środowiskiem roztworu przedstawia poniższy wykres:

Istnieją różne metody pomiaru pH. Jakościowo charakter ośrodka wodnych roztworów elektrolitów określa się za pomocą wskaźników.
Wskaźniki to substancje, które odwracalnie zmieniają swoją barwę w zależności od środowiska roztworu, tj. pH roztworu.
W praktyce stosuje się wskaźniki lakmus, oranż metylowy (oranż metylowy) i fenoloftaleina. Zmieniają barwę w małym zakresie pH: lakmus – w zakresie pH od 5,0 do 8,0; oranż metylowy – od 3,1 do 4,4 i fenoloftaleina – od 8,2 do 10,0.
Zmiana koloru wskaźników pokazana jest na schemacie: 
Zacienione obszary pokazują zakres zmian koloru wskaźnika.

Oprócz powyższych wskaźników stosuje się także wskaźnik uniwersalny, którym można w przybliżeniu określić pH w szerokim zakresie od 0 do 14.
Wartość pH ma ogromne znaczenie w procesach chemicznych i biologicznych, gdyż w zależności od charakteru środowiska procesy te mogą zachodzić z różną szybkością i w różnych kierunkach.
Dlatego określenie pH roztworów jest bardzo ważne w medycynie, nauce, technologii i rolnictwie. Zmiana pH krwi lub soku żołądkowego jest badaniem diagnostycznym w medycynie. Odchylenia pH od wartości prawidłowych, nawet o 0,01 jednostki, świadczą o procesach patologicznych w organizmie. Stałość stężeń jonów wodorowych H + jest jedną z ważnych stałych środowiska wewnętrznego organizmów żywych.
Zatem przy normalnej kwasowości sok żołądkowy ma pH 1,7; pH ludzkiej krwi wynosi 7,4; ślina - 6,9. Każdy enzym działa przy określonym pH: katalaza we krwi przy pH 7, sok żołądkowy pepsyna – przy pH 1,5-2; itp.
Czysta woda, choć słabo (w porównaniu z roztworami elektrolitów), może przewodzić prąd elektryczny. Jest to spowodowane zdolnością cząsteczki wody do rozpadu (dysocjacji) na dwa jony, które w czystej wodzie są przewodnikami prądu elektrycznego (poniżej dysocjacja oznacza dysocjację elektrolityczną - rozpad na jony):
H 2 O ↔ H + + OH -
Na około 556 000 000 niezdysocjowanych cząsteczek wody dysocjuje tylko 1 cząsteczka, ale jest to 60 000 000 000 zdysocjowanych cząsteczek w 1 mm3. Dysocjacja jest odwracalna, to znaczy jony H+ i OH - mogą ponownie utworzyć cząsteczkę wody. W końcu nadchodzi dynamiczny równowaga, w której liczba rozpadających się cząsteczek jest równa liczbie utworzonych jonów H + i OH -. Innymi słowy, prędkości obu procesów będą równe. W naszym przypadku równanie szybkości reakcji chemicznej można zapisać w następujący sposób:
υ 1 = κ 1 (dla dysocjacji wody)
υ 2 = κ 2 (dla procesu odwrotnego)
Gdzie υ - reakcja szybkościowa; κ - stała szybkości reakcji (zależna od rodzaju reagentów i temperatury); , I - stężenie (mol/l).
W stanie równowagi υ 1 = υ 2, stąd:
κ 1 = κ 2
Zróbmy prostą matematykę i otrzymajmy:
κ 1 / κ 2 = /
κ 1 / κ 2 = K
K- stała równowagi, a w naszym przypadku stała dysocjacji, która zależy od temperatury i charakteru substancji, a nie zależy od stężeń (a także κ 1 i κ 2). K dla wody 1,8 10 -16 przy 25°C (wartość odniesienia).
Ze względu na bardzo małą liczbę zdysocjowanych cząsteczek stężenie można przyjąć jako równe całkowitemu stężeniu wody, a całkowite stężenie wody w rozcieńczonych roztworach jako wartość stałą:
=1000(g/l)/18(g/mol)=55,6 mol/l.
Wymiana κ 1 / κ 2 NA K i używając wartości , ustalamy, jaki jest iloczyn stężeń I który jest nazywany - jonowy produkt wody:
K = /55,6 mola/l
1,8 10 -16 55,6 mol/l =
10 -14 =
Ponieważ w określonej temperaturze ilości stosowane do obliczenia iloczynu jonowego wody ( K, ) są stałe, wartość iloczynu jonowego wody cały czas to samo. A ponieważ dysocjacja cząsteczki wody wytwarza tę samą liczbę jonów I , okazuje się, że dla czystej wody stężenie I będzie równe 10-7 moli/l. Ze stałości produktu jonowego wody wynika, że jeśli liczba jonów H + staje się większa, to liczba jonów HO - maleje. Na przykład, jeśli do czystej wody doda się mocny kwas HCl, jako mocny elektrolit całkowicie rozdzieli się na H + i Cl -, w wyniku czego stężenie jonów H + gwałtownie wzrośnie, co doprowadzi do wzrost szybkości procesu odwrotnego do dysocjacji, ponieważ zależy on od stężenia jonów H+ i OH-:
υ 2 = κ 2
Podczas przyspieszonego procesu przeciwnego do dysocjacji stężenie jonów HO - zmniejszy się do wartości odpowiadającej nowej równowadze, przy której będzie ich na tyle mało, że szybkości dysocjacji wody i procesu odwrotnego znów będą równe. Jeżeli stężenie powstałego roztworu HCl wynosi 0,1 mol/l, oznacza to stężenie równowagowe będzie równe:
= 10 -14 /0,1 = 10 -13 mol/l
Po dodaniu mocnej zasady NaOH nastąpi przesunięcie w kierunku zmniejszenia stężenia H+.
Koniec pracy -
Ten temat należy do działu:
Chmury elektronowe orbitali o różnych wartościach l mają różne konfiguracje, a te z tymi samymi mają podobną konfigurację
Współczesna teoria mechaniki kwantowej stwierdza, że atom dowolnego pierwiastka ma złożoną strukturę, dodatnia część atomu to ładunek dodatni. Teoria kwantowa zakłada, że energię elektronu można tylko odebrać… więc w l s orbital dla elektronu o dowolnej wartości głównej liczby kwantowej n, chmura elektronów jest ograniczona.
Jeśli potrzebujesz dodatkowych materiałów na ten temat lub nie znalazłeś tego czego szukałeś, polecamy skorzystać z wyszukiwarki w naszej bazie dzieł:
Co zrobimy z otrzymanym materiałem:
Jeśli ten materiał był dla Ciebie przydatny, możesz zapisać go na swojej stronie w sieciach społecznościowych:
| Ćwierkać |
Wszystkie tematy w tym dziale:
Budowa atomów i zasada Pauliego
Zasada Pauliego pomaga wyjaśnić różnorodne zjawiska fizyczne. Konsekwencją tej zasady jest obecność powłok elektronowych w strukturze atomu, z czego z kolei wynikają różnorodne reakcje chemiczne
Podstawowe rodzaje wiązań chemicznych. Wiązanie kowalencyjne. Podstawowe zasady metody wiązań walencyjnych. Wiązania sigma i pikowalencyjne
atomy mogą łączyć się ze sobą, tworząc zarówno proste, jak i złożone substancje. W tym przypadku powstają różne rodzaje wiązań chemicznych: jonowe, kowalencyjne (niepolarne i polarne), metaliczne
Hybrydyzacja Sp
Występuje, gdy jedna orbita s i jedna p jest mieszanką. Powstają dwa równoważne orbitale sp-atomowe, rozmieszczone liniowo pod kątem 180 stopni i skierowane w różnych kierunkach od jądra atomu
Kształt geometryczny i polarność cząsteczek
Hybrydyzacja Kształt geometryczny Kąt między wiązaniami sp Liniowy 180° sp
Wiązanie jonowe jako graniczny przypadek polaryzacji wiązań kowalencyjnych. Elektrostatyczne oddziaływanie jonów
Wiązanie jonowe to bardzo silne wiązanie chemiczne utworzone pomiędzy atomami o dużej różnicy (>1,5 w skali Paulinga) elektroujemności, przy której wspólna para elektronów
Właściwości chemiczne tlenków zasadowych
1. Rozpuszczalne w wodzie tlenki zasadowe reagują z wodą tworząc zasady: Na2O + H2O → 2NaOH. 2. Oddziałuj z tlenkami kwasowymi, powodując
Właściwości chemiczne tlenków kwasowych
1. Reaguj z wodą tworząc kwas: SO3 + H2O → H2SO4. Ale nie wszystkie tlenki kwasowe reagują bezpośrednio z wodą (SiO
Właściwości chemiczne tlenków amfoterycznych
1. Reagują z kwasami tworząc sól i wodę: ZnO + 2HCl → ZnCl2 + H2O. 2. Reagować ze stałymi zasadami (podczas topnienia), powodując powstawanie
Fusy. Właściwości chemiczne zasad. Stany amfoteryczne, reakcje ich oddziaływania z kwasami i zasadami
Zasada to związek chemiczny zdolny do tworzenia wiązania kowalencyjnego z protonem (zasada Brønsteda
Charakterystyczne reakcje
Tlenki amfoteryczne reagują z mocnymi kwasami, tworząc sole tych kwasów. Reakcje takie są przejawem podstawowych właściwości tlenków amfoterycznych, np.: ZnO + H2SO4
Kwasy. Kwasy beztlenowe i tlenowe. Właściwości kwasów (siarkowy, solny, azotowy)
Kwasy to złożone substancje, których cząsteczki składają się z podstawialnych atomów wodoru i reszt kwasowych. Pozostałość kwasowa ma ładunek ujemny.
Kwas Siarkowy
Kwas siarkowy H2SO4 to mocny kwas dwuzasadowy odpowiadający najwyższemu stopniowi utlenienia siarki (+6). W normalnych warunkach stężony kwas siarkowy
Azotany
Kwas azotowy jest mocnym kwasem. Jego sole – azotany – powstają w wyniku działania HNO3 na metale, tlenki, wodorotlenki lub węglany. Wszystkie azotany są dobrze rozpuszczalne w wodzie. Jon azotanowy w
Kataliza homogeniczna
Przykładem katalizy jednorodnej jest rozkład nadtlenku wodoru w obecności jonów jodu. Reakcja przebiega w dwóch etapach: H2O2 + I → H2O + IO
Kataliza heterogeniczna
W katalizie heterogenicznej przyspieszenie procesu następuje zwykle na powierzchni ciała stałego – katalizatora, dlatego też aktywność katalizatora zależy od wielkości i właściwości jego powierzchni. W praktyce
Wpływ stężenia na szybkość reakcji chemicznej. Prawo akcji masowej
Aby substancje mogły zareagować, ich cząsteczki muszą się zderzyć. Prawdopodobieństwo zderzenia dwóch osób na ruchliwej ulicy jest znacznie większe niż na opuszczonej. To samo z cząsteczkami. Jest rzeczą oczywistą, że w
Wpływ temperatury na szybkość reakcji chemicznej. Energia aktywacji
Wpływ temperatury na liczbę zderzeń molekularnych można pokazać za pomocą modelu. W pierwszym przybliżeniu wpływ temperatury na szybkość reakcji określa reguła van’t Hoffa (sformułowana
Reakcje bez i z udziałem elektronów. Reakcje wymiany jonowej i redoks
Elektrony walencyjne określają zachowanie pierwiastka chemicznego w reakcjach chemicznych. Im mniej elektronów walencyjnych posiada pierwiastek, tym łatwiej je oddaje (wykazuje właściwości redukujące
Obraz reakcji wymiany jonowej
Reakcja wymiany w roztworze jest zwykle reprezentowana przez trzy równania: molekularne, w pełni jonowe i w skrócie jonowe. W równaniu jonowym słabe elektrolity, gazy i substancje słabo rozpuszczalne są reprezentowane przez m
Zasady zapisywania reakcji wymiany jonowej
Pisząc równania jonowe należy koniecznie kierować się tabelą rozpuszczalności kwasów, zasad i soli w wodzie, czyli koniecznie sprawdzić rozpuszczalność odczynników i produktów
Utlenianie
Utlenianie to proces utraty elektronów wraz ze wzrostem stopnia utlenienia. Kiedy substancja ulega utlenieniu, jej stopień utlenienia wzrasta w wyniku utraty elektronów. Na
Powrót do zdrowia
Redukcja to proces dodawania elektronów do atomu substancji, podczas gdy jej stopień utlenienia maleje. Redukując atomy lub jony, dodaję
Para Redox
Utleniacz i jego zredukowana postać lub reduktor i jego utleniona postać stanowią sprzężoną parę redoks, a ich wzajemne przemiany mają charakter utleniania
Rodzaje reakcji redoks
Międzycząsteczkowe - reakcje, w których atomy utleniające i redukujące zlokalizowane są w cząsteczkach różnych substancji, np.: H2S + Cl2 → S + 2HCl Int.
Utlenianie, redukcja
W reakcjach redoks elektrony są przenoszone z jednego atomu, cząsteczki lub jonu na inny. Proces utraty elektronów to utlenianie. Podczas utleniania stopień utlenienia wzrasta:
Interakcja z substancjami prostymi
Oddziaływanie z metalami: 2Na + Cl2 = 2NaCl, Fe + S = FeS, 6Li + N2 = 2Li3N, 2Ca + O2
Ułamek masowy
Ułamek masowy to stosunek masy substancji rozpuszczonej do masy roztworu. Ułamek masowy mierzy się w ułamkach jednostki lub w procentach:
Molalność (stężenie masy molowej, stężenie molowe)
Molalność to ilość substancji rozpuszczonej (liczba moli) w 1000 g rozpuszczalnika. Wyrażenie „molalność”, mierzone w molach na kg, jest również powszechne. Zatem roztwór o stężeniu 0.
Miano roztworu
Główny artykuł: Miano roztworu Miano roztworu to masa rozpuszczonej substancji w 1 ml roztworu.
Rozpuszczalność. Równowaga w układach heterogenicznych. Produkt rozpuszczalności słabo rozpuszczalnych substancji nieorganicznych
Rozpuszczalność to zdolność substancji do tworzenia jednorodnych układów z innymi substancjami - roztworami, w których substancja występuje w postaci pojedynczych atomów, jonów, cząsteczek lub
Wodne roztwory elektrolitów. Mocne i słabe elektrolity. Stała i stopień dysocjacji. Prawo rozcieńczeń Ostwalda
ROZTWORY ELEKTROLITÓW ROZTWORY ELEKTROLITÓW zawierają zauważalne stężenia jonów – kationów i anionów powstałych w wyniku dysocjacji elektrolitycznej
pH wody
Dla wygody stężenia wyrażono jako pH i pH hydroksylowe.
Dysocjacja mocnych elektrolitów. Aktywność jonów w roztworach. Współczynnik aktywności. Zrozumienie siły jonowej roztworów
Mocne elektrolity to związki chemiczne, których cząsteczki w rozcieńczonych roztworach są prawie całkowicie zdysocjowane na jony. Stopień dysocjacji takich elektrolitów jest bliski
Stopień hydrolizy
Stopień hydrolizy odnosi się do stosunku części soli ulegającej hydrolizie do całkowitego stężenia jej jonów w roztworze. Oznaczone α (lub hhydr);
Potencjał elektrody. Pojawienie się potencjalnego skoku na granicy międzyfazowej. Elektroda wodorowa. Standardowa elektroda wodorowa
Potencjał elektrody to różnica potencjałów elektrycznych pomiędzy elektrodą a stykającym się z nią elektrolitem (najczęściej pomiędzy metalem a roztworem elektrolitu
Korozja elektrochemiczna metali w różnych środowiskach
Kontaktowa korozja bimetaliczna jest rodzajem korozji elektrochemicznej spowodowanej kontaktem metali o różnych potencjałach elektrod w elektrolicie. Jednocześnie korozja metalu
Oddziaływanie chemiczne metali z roztworami kwasów zwykłych i kwasów utleniających
Kwas solny to techniczna nazwa kwasu solnego. Otrzymuje się go poprzez rozpuszczenie w wodzie gazowego chlorowodoru – HCl. Ze względu na słabą rozpuszczalność w wodzie, stężenie z
Rozcieńczony kwas siarkowy
W rozcieńczonym wodnym roztworze kwasu siarkowego większość jego cząsteczek dysocjuje: H2SO4
Stężony kwas siarkowy
W stężonym roztworze kwasu siarkowego (powyżej 68%) większość cząsteczek jest w stanie niezdysocjowanym, więc siarka działa jako środek utleniający
Proces elektrolizy. Procesy katodowe i anodowe. Kolejność wyładowań cząstek na anodzie i katodzie w zależności od wartości ich potencjału elektrodowego
Elektroliza to proces fizykochemiczny polegający na uwolnieniu na elektrodach części składowych substancji rozpuszczonych lub innych substancji powstałych w wyniku wtórnego
Reakcje katodowe
Ostatnia reakcja przebiega z wydzielaniem wodoru. Kiedy elek
Widok matematyczny
Prawa Faradaya można zapisać w postaci następującego wzoru: gdzie:
Konfiguracja atomów i jonów
Rozpuszczalność soli i wodorotlenków kationów, która leży u podstaw klasyfikacji analitycznej, podobnie jak wszystkie inne właściwości kationów, jest funkcjonalnie powiązana z położeniem odpowiednich pierwiastków w cyklu okresowym.
Rodzaje miareczkowania
Wyróżnia się miareczkowanie bezpośrednie, odwrotne i podstawnikowe. Podczas bezpośredniego miareczkowania do roztworu analitu (podwielokrotności lub próbki, miareczkowanej substancji) d
Rodzaje analizy miareczkowej
Analiza miareczkowa może opierać się na różnego rodzaju reakcjach chemicznych: miareczkowanie kwasowo-zasadowe – reakcje zobojętniania; miano redoks
Równoważna masa molowa substancji
Odpowiedniki masy molowej są zwykle zapisywane jako lub
Numer równoważny
Liczba równoważności z jest małą dodatnią liczbą całkowitą równą liczbie równoważników substancji zawartej w 1 molu tej substancji. Współczynnik równoważny
Cechy budowy atomu węgla. Nieorganiczne związki węgla (tlenki, węglany i wodorowęglany, węgliki) i ich właściwości
Węgiel jest podstawą związków organicznych i bioorganicznych oraz wielu polimerów. Większość związków węgla należy do substancji organicznych, ale w tej pracy zwrócimy na to uwagę
Dysocjacja wody. Indeks wodoru.
W Oda jest bardzo słabym elektrolitem. (Elektrolit to substancja, której roztwór lub stop przewodzi prąd elektryczny). Woda dysocjuje (rozpada się) na jony składowe:
H 2 O ↔ H + + OH -
Produkt jonowy wody K W = [H + ] · [OH - ] = 10 -14 = stała (stężenie molowe jonów mol/l jest zwyczajowo podawane w nawiasach kwadratowych). W praktyce do określenia środowiska wykorzystuje się wskaźnik wodorowy. Wykładnik wodoru ujemny logarytm dziesiętny stężenia molowego jonów wodorowych: pH= - log [H + ] i mieści się w zakresie 0<рН<14
|
Jony w roztworze |
Środa |
pH |
|
[H + ] > [OH - ] |
Kwaśny |
pH< 7 |
|
[H + ] = [OH - ] = 10 -7 mol/l |
Neutralny |
pH = - log [H + ] = - log 10 -7 = - (- 7) = 7 |
|
[OH - ] > [H + ] |
Alkaliczny |
pH > 7 |
|
Gdzie |
pH |
Gdzie |
pH |
|
żołądek |
Deszcz |
5,5-6,5 |
|
|
jelita |
8,5 - 9 |
Woda z kranu |
6-6,5-7 |
|
skóra |
5,5 -6 |
Woda morska |
8-8,5 |
|
krew |
7,35-7,45 |
Gleba |
4-10 |
Hydroliza
Nazywa się oddziaływaniem jonów soli z jonami wody, które zmienia wartość pH hydroliza. Jest to reakcja odwracalna.
Jeżeli pH nie zmienia się po rozpuszczeniu soli (pozostaje pH = 7), to hydroliza nie zachodzi.
Obecność słabego jonu w soli powoduje hydrolizę - to słaby jon przyłącza do siebie przeciwnie naładowany jon wody, tworząc w ten sposób nowy cząstka (z ładunkiem lub bez), a pozostały jon wody organizuje ośrodek: H+ - kwaśny, OH - - zasadowy.
Silne elektrolity.
|
Silne kwasy |
Mocne podstawy |
|
HCl ↔ H + + Cl - |
NaOH↔ Na + + OH − |
|
H 2 SO 4 ↔ 2 H + + SO 4 2− |
KOH↔ K + + OH − |
|
HNO 3 ↔ H + + NO 3 − |
Jeśli w tabeli nie ma cząstki, to tak będzie słaba cząstka (słaby jon).
Sól składa się z kationu (jonu dodatniego) i anionu (jonu ujemnego):
Ja + n KO - N (pozostałość kwasu)
Istnieją 4 możliwe kombinacje soli: 1. mocna + i mocna -
2. mocny + i słaby -
3. słaby + i mocny -
4.słaby + i słaby -
Rozważmy reakcje z następującymi zmianami jonów:
1. NaCl + H 2 O nie ma hydrolizy, ponieważ w soli nie ma słabych cząstek, a pH nie zmienia się (równe 7)
mocny + mocny
reakcja jest neutralna i ustępuje dysocjacja na jony: NaCl + H 2 O ↔ Na + + Cl − + H 2 O
2. hydroliza sody (techniczna)
Na2CO3 + H2O ↔
Silny + słaby
CO 3 2− + H + OH - ↔ H + CO 3 2− − + OH - środowisko zasadowe, pH>7, trzeba dalej pisać w formie molekularnej
Na 2 CO 3 + H 2 O ↔ Na + H + CO 3 2− O + Na + OH - O
3. Hydroliza siarczanu cynku
ZnSO4 + H2O ↔
Słaby + mocny
Zn +2 + H + OH - ↔ Zn +2 OH - + + H + środowisko kwaśne, pH<7, нужно далее написать в молекулярном виде
2 ZnSO 4 +2 H 2 O ↔ (Zn +2 OH - ) + 2 SO 4 2- O + H 2 + SO 4 2- O
4. Hydroliza węglanu glinu dobiega końca, ponieważ sól składa się z dwóch słabych cząstek.
Al 2 (С O 3 ) 3 + 6H 2 O ↔ 2Al(OH) 3 + 3H 2 CO 3
Elektrochemia
Jeśli metalową płytkę zanurzymy w roztworze jej soli, to na granicy fazy stałej i ciekłej utworzy się podwójna warstwa elektryczna, której wartość szacuje się na podstawie wartości potencjału elektrody φ. Dla wielu metali potencjały elektrod wyznacza się za pomocą elektrody wodorowej, której potencjał przyjmuje się za zero φ=0. Dane dotyczące potencjału elektrod przedstawiono w Tabeli nr 3 Załącznika w Metodzie 4/23/2 „Program pracy i zadanie badania”.
Standardowe potencjały elektrod ( 0 )
niektóre metale (zakres napięć) przy 298K.
|
Reakcja połówkowa elektrody |
Reakcja połówkowa elektrody |
||
|
Li + (wodny) + 1 e - = Li (sol.) |
3.045 |
Cd 2+ (aq) + 2 e - = Cd (sol) |
0.403 |
|
Rb + (aq) + 1 e - = Rb (sol) |
2.925 |
Co 2+ (aq) + 2e - = Co (sol) |
0.277 |
|
K + (aq) + 1 e - = K (sol) |
2.924 |
Ni 2+ (aq) + 2 e - = Ni (sol) |
0.250 |
|
Cs + (wodny) + 1 e - = Cs (sol.) |
2.923 |
Sn 2+ (aq) + 2 e - = Sn (sol) |
0.136 |
|
Ba 2+ (aq) + 2 e - = Ba (sol) |
2.905 |
Pb 2+ (wodny) + 2 e - = Pb (sol.) |
0.126 |
|
Ca 2+ (aq) + 2 e - = Ca (sol) |
2.866 |
Fe 3+ (wodny) + 3 e - = Fe (sol.) |
0.037 |
|
Na + (wodny) + e - = Na (sol.) |
2.714 |
2 H + (aq) + 2 e - = H 2 (g) |
0.000 |
|
Mg 2+ (aq) + 2 e - = Mg (sol) |
2.363 |
Sb 3+ (wodny) + 3 e - = Sb (sol.) |
0.200 |
|
Al 3+ (wodny) + 3 e - = Al (sol.) |
1.663 |
Bi 3+ (wodny) + 3 e - = Bi (sol.) |
0.215 |
|
Ti 2+ (aq) + 2 e - = Ti (sol) |
1.630 |
Cu 2+ (wodny) + 2 e - = C u (sol.) |
0.337 |
|
Zr 4+ (wodny) + 4 e - = Zr (sol.) |
1.539 |
Cu + (aq) + e - = Cu (sol) |
0.520 |
|
Mn 2+ (wodny) + 2 e - = Mn (sol.) |
1.179 |
Ag + (wodny) + e - = Ag (sol.) |
0.799 |
|
V 2+ (aq.) + 2 e - = V (sol.) |
1.175 |
Hg 2+ (aq) + 2 e - = Hg (l) |
0.850 |
|
Cr 2+ (aq) + 2 e - = Cr (sol) |
0.913 |
Pd 2+ (aq) + 2 e - = Pd (sol) |
0,987 |
|
Zn 2+ (wodny) + 2 e - = Zn (sol.) |
0.763 |
Pt 2+ (aq) + 2 e - = Pt (sol) |
1,188 |
|
Cr 3+ (wodny) + 3 e - = Cr (sol.) |
0.744 |
Au 3+ (wodny) + 3 e - = Au (sol.) |
1,498 |
|
Fe 2+ (aq) + 2 e - = Fe (sol) |
0.440 |
Au + (wodny) + e - = Au (sol.) |
1,692 |
Potencjały elektrod ze znakiem minus odnoszą się do metali, które wypierają wodór z kwasów. W tytule tabeli „Potencjały elektrod standardowych” odpowiadają potencjałom określonym w warunkach standardowych: temperatura t =25 0 C (T = 298 K), ciśnienie P = 1 atm, stężenie roztworu, w którym zanurzona jest elektroda C = 1 mol/l. φ 0 --- ul. standardowy
Im niższy potencjał elektrody φ, tym bardziej aktywny jest metal i tym większy jest w nim środek redukujący.
Przykład . Który metal jest bardziej aktywny, cynk czy aluminium? Odpowiedź: Aluminium, ponieważ jego potencjał (zgodnie z tabelą nr 3) jest mniejszy niż cynku.
Elementy galwaniczne.
Ogniwo galwaniczne (GC) to urządzenie, w którym energia reakcji chemicznej jest bezpośrednio przekształcana w energię elektryczną. GE składa się z połączonych ze sobą elektrod metalowych zanurzonych w roztworach ich soli. Metalowe płytki są połączone za pomocą urządzenia wskazującego. Półogniwa połączone są w obwód elektryczny za pomocą rurki wypełnionej roztworem przewodzącym (tzw. mostek solny). Na ryc. 1. Pokazano schemat miedziano-cynkowego ogniwa galwanicznego (Jacobi-Daniel). − Zn / Zn 2+ / / Cu 2+ / Cu +
Cyn Cu
- +
ZnSO 4 CuSO 4
Ryż. 1. Schemat ogniwa galwanicznego: 1 - elektroda (Zn); 2- naczynie z roztworem ZnSO 4 ; 3 - most solny; 4- naczynie z roztworem CuSO 4; 5-elektroda (Ci).
Wartości potencjałów elektrod dla cynku i miedzi zapisujemy z tabeli nr 3:
0 = 0,337 V 0 = −0,763 V
Cu 2+ / Cu 0 Zn 2+ / Zn 0
Rozważany jest metal o niższym potencjale elektrody anodę i utlenia się.
Widzimy, że potencjalna wartość cynku jest mniejsza niż miedzi, wnioskujemy, że cynk
anoda (służy jako elektroda ujemna) A Zn 0 - 2ē Zn 2+
Za metal o wyższym potencjale elektrody uważa się metal o wyższym potencjale elektrody atom i on jest przywracany.
Reakcja na prawej elektrodzie dla miedzi, ponieważ jest to katoda (pełni funkcję elektrody dodatniej), odpowiada procesowi redukcji:
K Cu 2+ + 2ē Cu 0
Ogniwa galwaniczne są reprezentowane przez następującą notację:
− Zn 0 / ZnSO 4 / / CuSO 4 / Cu 0 + lub w formie jonowej: – Zn 0 / Zn 2+ / / Cu 2+ / Cu 0
w którym linie pionowe symbolizują granicę roztworu metalu, a linia podwójna symbolizuje granicę pomiędzy roztworami elektrolitów.
Stanowisko GE ocenia się na podstawie wartości jego pola elektromagnetycznego (najwyższego napięcia, jakie może wytworzyć GE). Pole elektromagnetyczne ogniwa galwanicznego jest różnicą potencjałów elektrody utleniacza i reduktora, to znaczy jest równe różnicy potencjałów elektrody katody i anody.
E = K 0 − A 0 (1) Teoria E = K obliczona − A obliczona
Potencjał elektrody metalu zależy od stężenia jego jonów w roztworze.
Zależność tę wyraża równanie Nernsta:
gdzie - standardowy potencjał metalu, R - uniwersalna stała gazowa, T - temperatura bezwzględna, n - liczba pracujące elektrony , przechodząc od anody do katody, F - liczba Faradaya 1 F = 96500 C, C - stężenie jonów metali.
Jeżeli w powyższym równaniu stałe R i F zastąpimy ich wartościami liczbowymi, a logarytm naturalny wartością dziesiętną, wówczas przyjmie ono postać:
Jeżeli stężenia roztworów na elektrodach nie są takie same, to najpierw oblicz nowe wartości potencjałów dla katody i anody, skorygowane o stężenie zgodnie z równaniem Nernsta, a następnie podstaw je do równania (1).
Koncentracyjne ogniwo galwaniczne (CGE)składa się z dwóch płytek tego samego metalu zanurzonych w roztworach jego soli, które różnią się jedynie stężeniem. − Zn 0 / Zn 2+ / / Zn 2+ / Zn 0 +
Zn Zn
- +
ZnSO 4 Zn SO 4
C 1 C 2 Ryż. 2. Schemat ogniwa galwanicznego: 1,5 - elektrody (Zn); 2, 4 - naczynia z roztworem ZnSO 4 ; 3 - most solny.
Elektroda zanurzona w roztworzeniższe stężenie uważany za anodę.
Powiedzmy C1< С 2 , wówczas lewa elektroda 1 jest anodą, a prawa elektroda 2 będzie katodą. CGE działa do momentu wyrównania się stężeń C. 1 = C 2.
Korozja metalu
Jest to niszczenie (utlenianie) metali pod wpływem środowiska.
Polaryzacja spowalnianie korozji na skutek tworzenia się na powierzchni metalu: 1) cienkiego, niewidocznego dla oka filmu, który uniemożliwia dalsze wnikanie środka utleniającego; Mam taki film Al, Ti, Zn, Sn, Pb, Mn, Cd, Tl.
2) gruba warstwa produktów korozji (widoczna), która utrudnia podejście do samego metalu. W tym przypadku stopień polaryzacji zależy od porowatości tej warstwy. Na przykład zielona patyna na miedzi ma skład ( CuOH)2CO3 a jego porowatość jest mniejsza niż żelaza (produktem jest rdza Fe2O3nH2O ), dlatego patyna chroni miedź lepiej niż rdza chroni żelazo.
Depolaryzacja przyspieszenie korozji. Jest wodór i tlen.
1) Depolaryzacja wodoruwystępuje w środowisku kwaśnym (rozcieńczone kwasy HCl, H2SO4, HNO3 itp.). Podczas korozji elektrochemicznej, ponieważ do wielu metali wprowadzane są dodatki metali stopowych, a w wyniku różnic potencjałów powstają ogniwa mikrogalwaniczne, na katodzie przywracane jest środowisko, to znaczy wodór jest redukowany z kwasu:
K 2Н + + 2ē Н 0 2,
i na anodzie A utlenianie metali.
2) Depolaryzacja tlenuwystępuje w środowiskach obojętnych i lekko zasadowych (rozważamy korozję atmosferyczną)
K 2H 2 O + + O 2 + 4ē 4OH − ,
A Fe 0 - 2ē Fe 2+ utlenianie żelaza do Fe2+ na początku korozji, dopiero potem z biegiem czasu następuje utlenianie Fe3+.
Produkt korozji Fe (OH) 2 + O 2 → Fe (OH) 3 lub Fe 2 O 3 · nH 2 O żyto brunatne.
WNIOSEK: korozja (utlenianie) metalu jest zawsze procesem anodowym, a ośrodek regeneruje się na katodzie.
Wiele stężonych kwasów pasywować (blokuj, znacznie zmniejsz szybkość korozji) wiele metali. W ten sposób stężony kwas siarkowy pasywuje żelazo: na powierzchni tworzy się gęsty, cienki film FeSO4 , co zapobiega wnikaniu kwasu siarkowego.
Wpływ wartości pH na szybkość korozji.
Wykres 1 dla metali Al, Zn, Sn, Pb . Metale te są stabilne w środowisku obojętnym ze względu na amfoteryczność (w układzie okresowym stoją pomiędzy prawdziwymi metalami i niemetalami), a produkty korozji reagują zarówno z kwasami, jak i zasadami. Tym samym konieczne jest przygotowanie wody do pracy z aluminiowymi wymiennikami ciepła (poprawka: Glin stabilny przy pH=7; Pb przy pH=8; sen przy pH=9; charakter krzywej jest taki sam).
prędkość V KOR
korozja
V KOR
| |
0 7 pH 0 7 pH
Wykres 1. Wykres 2.
Wykres 2 przedstawia krzywą dla gruczoł: jest stabilny w środowiskach silnie zasadowych.
Metody ochrony metali przed korozją.
- Stopowaniemetale wprowadzenie dodatków metalicznych do metalu nieszlachetnego w celu uzyskania nowych właściwości: a) zwiększenie twardości szyn, kółMn, W, Zn, Kr, Ponitp.; b) podwyższona odporność na korozję różnych gatunków stali nierdzewnej; c) pojawienie się plastyczności i miękkości; d) właściwości ferromagnetyczne.
- Wstępinhibitory korozjisubstancje redukujące agresję środowiska: absorbery tlenu w roztworzeNie2 WIĘC3 ; moderatory katodowe tworzą warstwę na metalu (chromiany, dwuchromianyK2 Kr2 O7 , azotyny itp.); W środowiskach kwaśnych stosuje się związki organiczne (katapinę).
- Powłoki niemetaliczne: lakiery, farby, smary, woski, pasty, polimery, gumy, twarda guma. Zabezpieczenie gumą i ebonitem nazywa się gumowaniem.
- Ochrona elektrochemiczna: A)powłoki metalowe; b) zabezpieczenie bieżnika; c) ochrona katodowa.
- Zabezpieczenie przed prądem błądzącym: Uważa się, że 50% korozji w transporcie kolejowym powstaje na skutek prądów błądzących, które wpływają na wszystkie części taboru oraz elementy znajdujące się w podłożu. Ideą ochrony jest skierowanie części prądów poprzez prowadnice w ziemi, które połączone są z diodą, która organizuje przepływ prądu w jednym kierunku (ssanie).
- Obrona odkorozja mikrobiologiczna: lakiery i farby na bazie polimerów, wymiana powietrza, warunki temperaturowe nie wyższe niż 200 C i wilgotność nie większą niż 80%, konserwanty wykorzystujące inhibitory, ochrona protektorowa i katodowa.

Ochrona bieżnika:I- Stalowa konstrukcja,Ochrona katodowa:I- rura powlekana,
2-ochraniacz, 3- wypełniacz, 4- elektryczne 2- przewody łączące, 3- źródło
kontakt z konstrukcją, 5 sterowania DC, 4 anody.
terminal pomiarowy (IPZPrąd ochronny Mechanizm: elektroliza
ochrona). Mechanizm: GE
Nanadepnąć(anodowe) zabezpieczenie elektrochemiczne, do zabezpieczanej konstrukcji metalowej przymocowany jest ochraniacz - metal za pomocąbardziej ujemna wartość potencjału elektrody. Aktywność metalu wybranego jako zabezpieczenie można ocenić na podstawie promienia działania ochraniacza, tj. odległość, na jaką rozciąga się działanie wybranego metalu. Do ochrony bieżnika stali najczęściej stosuje się cynk, a także aluminium, kadm i magnez. Promień zabezpieczenia bieżnika wynosi około 50 m.
Przy zabezpieczaniu kabli, rurociągów i innych konstrukcji znajdujących się w ziemi montuje się ochraniacze cynkowe w składzie wypełniacza: 25% CaSO4 2H2 Och, 28% Na2 WIĘC4 · 10 N2 Och, 50% gliny. Ochraniacze do montażu w gruncie wykonywane są najczęściej w formie cylindrów. Na styk z przewodem łączącym, który jest zwykle lutowany, ochraniacz posiada rdzeń ze stali ocynkowanej.
Szybkość korozji przy zabezpieczeniu anodowym można zmniejszyć do wartości minimalnej odpowiadającej pełnemu prądowi polaryzacji, ale nigdy nie zmniejsza się do zera, jak w przypadku ochrony katodowej.
KatodaOchrona elektrochemiczna stosowana jest do ochrony wyrobów metalowych znajdujących się w gruncie. Odbywa się to poprzez podłączenie konstrukcji metalowych do bieguna ujemnego zewnętrznego źródła prądu stałego. Z ochroną katodowąJako elektrodę pomocniczą (anodę) stosuje się materiały nierozpuszczalne (grafit, węgiel) lub rozpuszczający się złom (szyny, stare rury), które należy okresowo wymieniać. W przypadku zwalczania korozji podziemnej, biegun dodatni zewnętrznego źródła prądu jest uziemiony. Zasięg ochrony katodowej wynosi około 2 km.

Zabezpieczenie przed prądem błądzącym: Ipodstacja prostownikowa, 2- sieć trakcyjna, 3- szyny, 4- grunt, 5- prąd błądzący, 6- rurociąg, 7- dioda, 8- zworka metalowa.
Aby chronić podziemne konstrukcje metalowe przed zniszczeniem przez prądy błądzące, stosuje się jezabezpieczenie odpływu prądu elektrycznego. Odbywa się to poprzez połączenie odcinka anodowego konstrukcji podziemnej (rury) metalowym przewodnikiem ze źródłem prądów błądzących, na przykład szyną. Prąd przepływa przez metalowy przewodnik, w wyniku czego eliminowana jest różnica potencjałów masa-szyna, a tym samym niebezpieczeństwo korozji. Ponieważ prąd w zelektryfikowanych kolejach może często zmieniać kierunek, dla większej niezawodności ochrony stosuje się spolaryzowany drenaż elektryczny. W tym celu w metalowych złączach znajduje się prostownik, na przykład dioda krzemowa lub germanowa, który zapewnia przepływ prądu tylko w pożądanym kierunku.
ELEKTROLIZA
Jest to przemiana substancji pod wpływem prądu elektrycznego. Jednocześnie dalejkatodasą przywracanecząstki dodatnie (kationy)i dalejanodautleniaćcząstki ujemne (aniony).
Stosowany w elektrolizierozpuszczalny(metalowe) inierozpuszczalny(węgiel)elektrody.Rozpuszczalność elektrody jest ważna tylko w procesie anodowym. Domyślnie stosowane są elektrody węglowe.
Pierwsze prawo Faradaya.
Podczas przepuszczania pewnej ilości prądu przez roztwór lub stopioną substancję 1F= 96500 C, na katodzie i anodzie uwalnia się jeden równoważnik produktów elektrolizy.
Drugie prawo Faradaya.
Masa lub objętość produktu elektrolizy zależy bezpośrednio od natężenia prądu, czasu przepływu prądu i charakteru produktu elektrolizy.
I,
GdzieI obecna siła, A;T czas, s; miszturchać równoważnik masy, G;miVszturchać równoważnik objętościowy, l.Wyjście prądowe
Elektroliza charakteryzuje się wysokimi wartościami wydajności prądowej: 97-99%.
Elektrolizę wykorzystuje się do produkcji substancji o wysokiej czystości, metali, do powlekania, galwanizacji, elektroformowania, rozdzielania mieszanin substancji, do elektrokoagulacji, do produkcji wodoru jako paliwa alternatywnego, w katodowej ochronie antykorozyjnej itp.
Zasady zapisywania równań elektrolizy roztworów wodnych.
- Redukcja kationów na katodzie.
a) Jeżeli sól metaliczna znajduje się w „szeregu napięcia” doGlinwłącznie, następnie wodór jest redukowany z wody na katodzie, a metal pozostaje w roztworze:
DO2H+ + 2ē → N0 2
B) Jeśli sól metaliczna znajduje się w „szeregu napięcia” odTido H włącznie, wówczas na katodzie redukowany jest zarówno wodór z wody, jak i metal:
DO2H+ + 2ē → N0 2 IKr3+ + 3ē →Kr0
V)Jeżeli sól metaliczna znajduje się w „szeregu napięcia” po wodorze, wówczas na katodzie następuje redukcja jednego metalu:
DOAg+ + 1 ē → Ag0
- Utlenianie anionów na anodzie
A)do elektrod nierozpuszczalnych (węglowych).:
S2- , I- , br - , kl- OH- ,NIE3 - ,WIĘC4 2- , PO4 3-
wzrastająca trudność utleniania anionów.
B)do elektrod rozpuszczalnych (metalowych).:
aniony soli pozostają w roztworze irozpuszczalny metalowy materiał anody utlenia się.
STRONA 7
kation+
anion −
Jonowy produkt wody to iloczyn stężeń jonów wodorowych H+ i jonów wodorotlenkowych OH? w wodzie lub w roztworach wodnych, stała autoprotolizy wody. Wyświetlanie wartości iloczynu jonowego wody
Woda, mimo że jest słabym elektrolitem, w niewielkim stopniu dysocjuje:
H2O + H2O - H3O+ + OH? lub H2O - H+ + OH?
Równowaga tej reakcji jest silnie przesunięta w lewo. Stałą dysocjacji wody można obliczyć ze wzoru:
Stężenie jonów hydroniowych (protonów);
stężenie jonów wodorotlenkowych;
Stężenie wody (w postaci molekularnej) w wodzie;
Stężenie wody w wodzie, biorąc pod uwagę jej niski stopień dysocjacji, jest praktycznie stałe i wynosi (1000 g/l)/(18 g/mol) = 55,56 mol/l.
W temperaturze 25 ° C stała dysocjacji wody wynosi 1,8 × 10 × 16 mol/l. Równanie (1) można zapisać w następujący sposób: Oznaczmy iloczyn K· = Kw = 1,8×10 x 16 mol/l · 55,56 mol/l = 10 x 14mol/l = · (w 25°C).
Stała Kw, równa iloczynowi stężeń protonów i jonów wodorotlenkowych, nazywana jest iloczynem jonowym wody. Jest stała nie tylko dla czystej wody, ale także dla rozcieńczonych wodnych roztworów substancji. Wraz ze wzrostem temperatury wzrasta dysocjacja wody, dlatego wzrasta również Kw; wraz ze spadkiem temperatury i odwrotnie. Praktyczne znaczenie produktu jonowego wody
Praktyczne znaczenie produktu jonowego wody jest ogromne, ponieważ pozwala przy znanej kwasowości (zasadowości) dowolnego roztworu (to znaczy przy znanym stężeniu lub ) znaleźć odpowiednie stężenie lub . Chociaż w większości przypadków dla wygody prezentacji nie stosuje się wartości bezwzględnych stężeń, ale ich logarytmy dziesiętne przyjmowane z przeciwnym znakiem - odpowiednio wskaźnik wodorowy (pH) i wskaźnik hydroksylowy (pOH).
Ponieważ Kb jest stałą, po dodaniu kwasu (jony H+) do roztworu stężenie jonów wodorotlenkowych OH? spadnie i odwrotnie. W neutralnym środowisku = = mol/l. Przy stężeniu > 10–7 mol/l (odpowiednio stężenie< 10?7 моль/л) среда будет кислой; При концентрации >10–7 mol/l (odpowiednio stężenie< 10?7 моль/л) -- щелочной.
Dysocjacja elektrolityczna wody. wartość PH
Woda jest słabym amfoterycznym elektrolitem:
H2O H+ + OH- lub dokładniej: 2H2O H3O+ + OH-
Stała dysocjacji wody w temperaturze 25°C jest równa: Wartość tej stałej odpowiada dysocjacji jednej ze stu milionów cząsteczek wody, zatem stężenie wody można uznać za stałe i równe 55,55 mol/l (gęstość wody 1000 g/l, masa 1 litra 1000 g, ilość substancji wodnej 1000 g: 18 g/mol=55,55 mol, C=55,55 mol: 1 l = 55,55 mol/l). Następnie
Wartość ta jest stała w danej temperaturze (25°C), nazywana jest iloczynem jonowym wody KW:
Dysocjacja wody jest procesem endotermicznym, dlatego wraz ze wzrostem temperatury, zgodnie z zasadą Le Chateliera, dysocjacja nasila się, produkt jonowy wzrasta i osiąga wartość 10-13 w temperaturze 100°C.
W czystej wodzie o temperaturze 25°C stężenia jonów wodorowych i hydroksylowych są równe:
10-7 mol/l Roztwory, w których stężenia wodoru i jonów hydroksylowych są równe, nazywane są obojętnymi. Jeśli do czystej wody doda się kwas, stężenie jonów wodorowych wzrośnie i będzie większe niż 10-7 mol/l, środowisko stanie się kwaśne, a stężenie jonów hydroksylowych natychmiast się zmieni, tak że produkt jonowy wody zatrzyma się jego wartość wynosi 10-14. To samo stanie się, gdy dodasz alkalia do czystej wody. Stężenia jonów wodorowych i hydroksylowych są ze sobą powiązane poprzez iloczyn jonowy, dlatego znając stężenie jednego z jonów, łatwo jest obliczyć stężenie drugiego. Na przykład, jeśli = 10-3 mol/l, to = KW/ = 10-14/10-3 = 10-11 mol/l, lub jeśli = 10-2 mol/l, to = KW/ = 10-14 /10-2 = 10-12 mol/l. Zatem stężenie jonów wodorowych lub hydroksylowych może służyć jako ilościowa charakterystyka kwasowości lub zasadowości ośrodka.
W praktyce nie stosuje się w nich stężeń jonów wodorowych czy hydroksylowych, lecz wskaźniki pH wodoru lub hydroksylu pOH.Wskaźnik pH wodoru jest równy ujemnemu logarytmowi dziesiętnemu stężenia jonów wodorowych:
Indeks hydroksylowy pOH jest równy ujemnemu logarytmowi dziesiętnemu stężenia jonów hydroksylowych:
pOH = - log
Łatwo to wykazać, biorąc logarytm iloczynu jonowego wody
pH + pH = 14
Jeśli pH środowiska wynosi 7, środowisko jest obojętne, jeśli jest mniejsze niż 7, jest kwaśne, a im niższe pH, tym wyższe stężenie jonów wodorowych. Wartość pH większa niż 7 oznacza, że środowisko jest zasadowe; im wyższe pH, tym wyższe stężenie jonów hydroksylowych. Czysta woda bardzo słabo przewodzi prąd, ale nadal ma mierzalną przewodność elektryczną, co tłumaczy się niewielką dysocjacją wody na jony wodorowe i jony wodorotlenkowe. Na podstawie przewodności elektrycznej czystej wody można określić stężenie jonów wodorowych i wodorotlenkowych w wodzie.
Ponieważ stopień dysocjacji wody jest bardzo mały, stężenie niezdysocjowanych cząsteczek w wodzie jest praktycznie równe całkowitemu stężeniu wody, dlatego z wyrażenia na stałą dysocjacji wody wynika, że dla wody i rozcieńczonej wody roztworów w stałej temperaturze, iloczyn stężeń jonów wodorowych i jonów wodorotlenkowych jest wartością stałą. Stała ta nazywana jest produktem jonowym wody.
Roztwory, w których stężenia jonów wodorowych i wodorotlenkowych są takie same, nazywane są obojętnymi. Roztwory kwaśne zawierają więcej jonów wodorowych, natomiast roztwory zasadowe zawierają więcej jonów wodorotlenkowych. Ale iloczyn ich stężeń jest zawsze stały. Oznacza to, że jeśli znane jest stężenie jonów wodorowych w roztworze wodnym, to wyznacza się również stężenie jonów wodorotlenkowych. Dlatego zarówno stopień kwasowości, jak i stopień zasadowości roztworu można scharakteryzować ilościowo na podstawie stężenia jonów wodorowych:
Kwasowość lub zasadowość roztworu można wyrazić w wygodniejszy sposób: zamiast stężenia jonów wodorowych należy wskazać jego logarytm dziesiętny, wzięty z przeciwnym znakiem. Ostatnia wartość nazywana jest indeksem wodorowym i oznaczana jest jako pH:. Z tego jasno wynika, że w roztworze obojętnym pH = 7; w roztworach kwaśnych pH<7 и тем меньше, чем кислее раствор; в щелочных растворах рН>7, a im więcej, tym większa zasadowość roztworu.
Istnieją różne metody pomiaru pH. Przybliżoną reakcję roztworu można określić za pomocą specjalnych reaktorów zwanych wskaźnikami, których kolor zmienia się w zależności od stężenia jonów wodorowych. Najczęściej spotykane to oranż metylowy, czerwień metylowa, fenoloftaleina i lakmus.