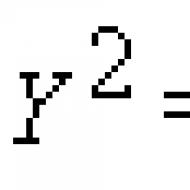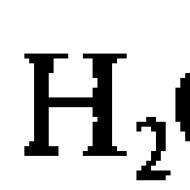Disociácia vody. hodnota pH
Čistá voda, aj keď slabo (v porovnaní s roztokmi elektrolytov), môže viesť elektrický prúd. Je to spôsobené schopnosťou molekuly vody rozpadnúť sa (disociovať) na dva ióny, ktoré sú vodičmi elektrického prúdu v čistej vode (nižšie, disociácia znamená elektrolytickú disociáciu - rozklad na ióny): H 2 O ↔ H + + OH -
Na približne 556 000 000 nedisociovaných molekúl vody sa disociuje iba 1 molekula, ale toto je 60 000 000 000 disociovaných molekúl v 1 mm3. Disociácia je reverzibilná, to znamená, že ióny H + a OH - môžu opäť vytvoriť molekulu vody. Výsledkom je dynamická rovnováha, v ktorej sa počet rozpadnutých molekúl rovná počtu vytvorených iónov H + a OH -. Inými slovami, rýchlosti oboch procesov budú rovnaké. Pre náš prípad možno rovnicu rýchlosti chemickej reakcie napísať takto:
υ 1 = κ 1 (pre disociáciu vody)
υ 2 = κ 2 (pre opačný proces)
kde υ je rýchlosť reakcie; κ je rýchlostná konštanta reakcie (v závislosti od povahy reaktantov a teploty); , a - koncentrácie (mol/l).
V rovnovážnom stave υ 1 = υ 2 teda: κ 1 = κ 2
Pretože pri určitej teplote sú množstvá použité pri výpočte iónového produktu vody (K, ) konštantné, je konštantná aj hodnota iónového produktu vody. A keďže disociáciou molekuly vody vzniká rovnaký počet iónov a , ukazuje sa, že pre čistú vodu budú koncentrácie a rovné 10 -7 mol/l. Zo stálosti iónového produktu vody vyplýva, že ak sa počet iónov H + zväčší, potom sa počet iónov HO - zmenší. Napríklad, ak sa do čistej vody pridá silná kyselina HCl, ako silný elektrolyt sa úplne disociuje na H + a Cl -, v dôsledku čoho sa koncentrácia iónov H + prudko zvýši, čo povedie k zvýšenie rýchlosti procesu oproti disociácii, pretože závisí od koncentrácie iónov H + a OH -: υ 2 = κ 2
Počas zrýchleného procesu opačného k disociácii sa koncentrácia HO - iónov zníži na hodnotu zodpovedajúcu novej rovnováhe, pri ktorej ich bude tak málo, že rýchlosti disociácie vody a reverzného procesu budú opäť rovnaké. Ak je koncentrácia výsledného roztoku HCl 0,1 mol/l, rovnovážna koncentrácia sa bude rovnať: = 10 -14 /0,1 = 10 -13 mol/l
Iónový produkt vodý je súčin koncentrácií vodíkových iónov H + a hydroxylových iónov OH − vo vode alebo vo vodných roztokoch, autoprotolytická konštanta vody.
Voda, hoci je slabým elektrolytom, disociuje v malom rozsahu:
Rovnováha tejto reakcie je výrazne posunutá doľava. Disociačnú konštantu vody možno vypočítať pomocou vzorca:
· - koncentrácia hydróniových iónov (protónov);
· - koncentrácia hydroxidových iónov;
· - koncentrácia vody (v molekulárnej forme) vo vode;
Koncentrácia vody vo vode, berúc do úvahy jej nízky stupeň disociácie, je prakticky konštantná a predstavuje (1000 g/l)/(18 g/mol) = 55,56 mol/l.
Pri 25 °C je disociačná konštanta vody 1,8 10 −16 mol/l. Rovnica (1) sa dá prepísať takto:
Konštanta Kin, ktorá sa rovná súčinu koncentrácií protónov a hydroxidových iónov, sa nazýva iónový súčin vody.. Je konštantná nielen pre čistú vodu, ale aj pre zriedené vodné roztoky látok. So zvyšujúcou sa teplotou sa zvyšuje disociácia vody, preto sa zvyšuje aj Kv, s klesajúcou teplotou - naopak. Praktický význam iónového produktu vody je veľký, pretože umožňuje pri známej kyslosti (alkalite) akéhokoľvek roztoku (teda pri známej koncentrácii alebo ) nájsť zodpovedajúcu koncentráciu alebo . Aj keď vo väčšine prípadov pre pohodlie prezentácie nepoužívajú absolútne hodnoty koncentrácií, ale ich desatinné logaritmy s opačným znamienkom - vodíkový index (pH) a hydroxylový index (pOH).
Pretože Kb je konštanta, po pridaní kyseliny (H + iónov) do roztoku koncentrácia hydroxidových iónov OH − klesne a naopak. V neutrálnom prostredí = = mol/l. Pri koncentrácii > 10 -7 mol/l (resp< 10 −7 моль/л) среда будет kyslé; Pri koncentrácii > 10 -7 mol/l (resp< 10 −7 моль/л) - zásadité.
27. Tlmiace roztoky: ich zloženie, vlastnosti, mechanizmus účinku. Kapacita vyrovnávacej pamäte
Tlmiace roztoky- ide o roztoky obsahujúce pufrovacie systémy. Pufrové systémy sú zmesi, ktoré obsahujú slabé kyseliny a ich soli so silnými zásadami alebo slabé zásady a ich soli so silnými kyselinami v určitom kvantitatívnom pomere. Takéto roztoky majú po zriedení neutrálnym rozpúšťadlom (vodou) stabilnú koncentráciu H+ iónov a pridáva sa do nich určité množstvo silných kyselín alebo zásad.
Tlmiace roztoky sa nachádzajú vo vodách svetových oceánov, pôdnych roztokoch a živých organizmoch. Tieto systémy plnia funkcie regulátorov, ktoré udržujú aktívnu reakciu prostredia na určitej hodnote potrebnej pre úspešný priebeh metabolických reakcií. Tlmiace roztoky sa delia na kyslé a zásadité. Príkladom prvého by bol acetátový tlmivý systém a príkladom druhého by bol amónny tlmivý systém. Existujú prírodné a umelé pufrovacie roztoky. Prirodzeným tlmivým roztokom je krv, ktorá obsahuje hydrogénuhličitanové, fosfátové, bielkovinové, hemoglobínové a kyslé tlmiace systémy. Umelým tlmivým roztokom môže byť acetátový tlmivý roztok pozostávajúci z CH3COOH.
Uvažujme o vlastnostiach vnútorného zloženia a mechanizmu účinku tlmivých systémov na príklade acetátového tlmivého systému: kyselina octová/octan sodný. Vo vodnom prostredí komponenty pufrovacieho systému podliehajú elektrolytickej disociácii. Octan sodný ako soľ slabej kyseliny a silnej zásady úplne disociuje na ióny. Prítomnosť aniónov v takejto tlmivej zmesi závisí od koncentrácie soli v nej a od stupňa jej disociácie. Koncentrácia iónov H+ v tlmivom systéme je priamo úmerná koncentrácii kyseliny v ňom a nepriamo úmerná obsahu soli tejto kyseliny v ňom.
Koncentrácia iónov H+ v hlavnom pufri je teda priamo úmerná koncentrácii soli v ňom a nepriamo úmerná koncentrácii zásady.
Napríklad je potrebné pripraviť acetátový pufor s niekoľkými hodnotami pH. Najprv pripravte 5M roztoky kyseliny octovej a octanu sodného. Na prípravu prvého roztoku vezmite 50 ml každej zložky. Podľa vzorca určte koncentráciu iónov H+ vo výslednom roztoku.
Pre ďalší tlmivý roztok vezmite 80 ml roztoku kyseliny a 20 ml predtým pripraveného roztoku soli. Existuje množstvo receptov na rôzne pufrovacie roztoky používané v chemickej analýze a laboratórnej praxi.
Tlmiace roztoky sa vyznačujú určitými vlastnosťami. Medzi ne patrí predovšetkým pufrovanie - schopnosť udržiavať konštantnú koncentráciu iónov H+, keď sa do roztoku pufra pridá určité množstvo silnej kyseliny alebo silnej zásady. Napríklad, ak sa do acetátového tlmivého roztoku pridá malé množstvo chloridovej kyseliny, pH sa neposunie na kyslú stranu, pretože chloridová kyselina podstúpi výmennú rozkladnú reakciu so soľou slabej kyseliny. V dôsledku reakcie je silná kyselina, ktorá môže posunúť pH na kyslú stranu, nahradená slabou kyselinou a neutrálnou soľou. Stupeň disociácie slabého roztoku elektrolytu klesá so zvyšovaním jeho koncentrácie, má tendenciu k nule a nedochádza k posunu pH.
Kapacita vyrovnávacieho roztoku(z angličtiny vyrovnávacej pamäte- tlmič, angl buff- zmiernenie nárazov) - množstvo kyseliny alebo zásady potrebné na zmenu pH tlmivého roztoku presne o 1.
Tlmivá zmes, tlmivý roztok, tlmivý systém- kombinácia látok, systém, ktorý udržuje konštantné pH.
Voda- slabý amfotérny elektrolyt.
Rovnica pre ionizáciu vody s prihliadnutím na hydratáciu vodíkových iónov H + je nasledovná:
Bez zohľadnenia hydratácie iónov H + má rovnica disociácie vody tvar:
![]()
Ako je zrejmé z druhej rovnice, koncentrácie vodíkových iónov H + a hydroxidových iónov OH - vo vode sú rovnaké. Pri 25 °C [H+] = [OH-] = 10-7 mol/l.
Súčin koncentrácií vodíkových iónov a hydroxidových iónov je tzv iónový produkt vody(KH20).
KH20 = ∙
K H 2 O je konštantná hodnota a pri teplote 25 o C
KH20 = 10-7 ∙10-7 = 10-14
V zriedených vodných roztokoch elektrolytov, podobne ako vo vode, je súčin koncentrácií vodíkových iónov H + a hydroxidových iónov OH - konštantná hodnota pri danej teplote. Iónový produkt vody umožňuje každému vodnému roztoku vypočítať koncentráciu hydroxidových iónov OH - ak je známa koncentrácia vodíkových iónov H + a naopak.
Prostredie akéhokoľvek vodného roztoku môže byť charakterizované koncentráciou vodíkových iónov H + alebo hydroxidových iónov OH -.
Vo vodných roztokoch existujú tri typy médií: neutrálne, alkalické a kyslé.
Neutrálne prostredie je prostredie, v ktorom sa koncentrácia vodíkových iónov rovná koncentrácii hydroxidových iónov:
[H+] = = 10-7 mol/l
Kyslé prostredie je prostredie, v ktorom je koncentrácia vodíkových iónov väčšia ako koncentrácia hydroxidových iónov:
[H+] > [OH-], > 10-7 mol/l
Alkalické prostredie je médium, v ktorom je koncentrácia vodíkových iónov nižšia ako koncentrácia hydroxidových iónov:
< , < 10 -7 моль/л
Na charakterizáciu prostredia roztoku je vhodné použiť takzvanú hodnotu pH (pH).
hodnota pH sa nazýva záporný dekadický logaritmus koncentrácie vodíkových iónov: pH = -log.
Napríklad, ak = 10 -3 mol/l, potom pH = 3, médium roztoku je kyslé; ak [H + ] = 10 -12 mol/l, potom pH = 12, médium v roztoku je alkalické: 
Hodnota pH je nižšia ako 7, čím je roztok kyslejší. Hodnota pH je väčšia ako 7, tým väčšia je zásaditosť roztoku.
Vzťah medzi koncentráciou iónov H +, hodnotou pH a prostredím roztoku je znázornený na nasledujúcom diagrame:

Existujú rôzne metódy merania pH. Kvalitatívne sa charakter média vodných roztokov elektrolytov určuje pomocou indikátorov.
Ukazovatele sú látky, ktoré reverzibilne menia svoju farbu v závislosti od prostredia roztoku, t.j. pH roztoku.
V praxi sa používajú ukazovatele lakmus, metyl pomaranč (metyl pomaranč) a fenolftaleín. Menia svoju farbu v malom rozsahu pH: lakmus - v rozsahu pH od 5,0 do 8,0; metylová oranž - od 3,1 do 4,4 a fenolftaleín - od 8,2 do 10,0.
Zmena farby indikátorov je znázornená na obrázku: 
Tieňované oblasti zobrazujú rozsah zmien farby indikátora.

Okrem vyššie uvedených indikátorov sa používa aj univerzálny indikátor, ktorým je možné približne určiť pH v širokom rozmedzí od 0 do 14.
Hodnota pH má veľký význam v chemických a biologických procesoch, keďže v závislosti od charakteru prostredia môžu tieto procesy prebiehať rôznou rýchlosťou a rôznymi smermi.
Preto je stanovenie pH roztokov veľmi dôležité v medicíne, vede, technike a poľnohospodárstve. Zmena pH krvi alebo žalúdočnej šťavy je diagnostickým testom v medicíne. Odchýlky pH od normálnych hodnôt, dokonca aj o 0,01 jednotky, naznačujú patologické procesy v tele. Stálosť koncentrácií vodíkových iónov H + je jednou z dôležitých konštánt vnútorného prostredia živých organizmov.
Pri normálnej kyslosti má teda žalúdočná šťava pH 1,7; pH ľudskej krvi je 7,4; sliny - 6.9. Každý enzým funguje pri určitej hodnote pH: krvná kataláza pri pH 7 žalúdočná šťava pepsín - pri pH 1,5-2; atď.
Čistá voda, aj keď slabo (v porovnaní s roztokmi elektrolytov), môže viesť elektrický prúd. Je to spôsobené schopnosťou molekuly vody rozpadnúť sa (disociovať) na dva ióny, ktoré sú vodičmi elektrického prúdu v čistej vode (nižšie disociácia znamená elektrolytickú disociáciu - rozpad na ióny):
H 2 O ↔ H + + OH -
Na približne 556 000 000 nedisociovaných molekúl vody sa disociuje iba 1 molekula, ale toto je 60 000 000 000 disociovaných molekúl v 1 mm3. Disociácia je reverzibilná, to znamená, že ióny H + a OH - môžu opäť vytvoriť molekulu vody. Nakoniec to príde dynamický rovnováha, v ktorej sa počet rozpadnutých molekúl rovná počtu vytvorených iónov H + a OH -. Inými slovami, rýchlosti oboch procesov budú rovnaké. Pre náš prípad možno rovnicu rýchlosti chemickej reakcie napísať takto:
υ 1 = κ 1 (pre disociáciu vody)
υ 2 = κ 2 (pre opačný proces)
Kde υ - rýchlostná reakcia; κ - konštanta reakčnej rýchlosti (v závislosti od povahy reaktantov a teploty); , A - koncentrácia (mol/l).
V stave rovnováhy υ 1 = υ 2, teda:
K 1 = K 2
Urobme jednoduchú matematiku a získame:
κ 1 /K 2 = /
K1/K2 = K
K- rovnovážna konštanta a v našom prípade disociačná konštanta, ktorá závisí od teploty a povahy látok a nezávisí od koncentrácií (rovnako ako κ 1 a κ 2). K pre vodu 1,8 10 -16 pri 25 °C (referenčná hodnota).
Vzhľadom na veľmi malý počet disociovaných molekúl sa koncentrácia možno považovať za rovnú celkovej koncentrácii vody a celkovú koncentráciu vody v zriedených roztokoch ako konštantnú hodnotu:
= 1000 (g/l)/18 (g/mol) = 55,6 mol/l.
Výmena K 1 / K 2 na K a pomocou magnitúdy , určíme, čomu sa rovná súčin koncentrácií A ktorá sa volá - iónový produkt vody:
K = /55,6 mol/l
1,8 10 -16 55,6 mol/l =
10 -14 =
Pretože pri určitej teplote sa množstvá použité pri výpočte iónového produktu vody ( K, ) sú konštantné, hodnota iónového produktu vody stále to isté. A keďže disociáciou molekuly vody vzniká rovnaký počet iónov A , ukazuje sa, že pre čistú vodu je koncentrácia A budú rovné 10-7 mol/l. Zo stálosti iónového produktu vody vyplýva, že ak sa počet iónov H + zväčší, potom sa počet iónov HO - zmenší. Napríklad, ak sa do čistej vody pridá silná kyselina HCl, ako silný elektrolyt sa úplne disociuje na H + a Cl -, v dôsledku čoho sa koncentrácia iónov H + prudko zvýši, čo povedie k zvýšenie rýchlosti procesu oproti disociácii, pretože závisí od koncentrácie iónov H+ a OH-:
υ 2 = κ 2
Počas zrýchleného procesu opačného k disociácii sa koncentrácia HO - iónov zníži na hodnotu zodpovedajúcu novej rovnováhe, pri ktorej ich bude tak málo, že rýchlosti disociácie vody a reverzného procesu budú opäť rovnaké. Ak je koncentrácia výsledného roztoku HCl 0,1 mol/l, ide o rovnovážnu koncentráciu sa bude rovnať:
= 10-14 /0,1 = 10-13 mol/l
Pri pridávaní silnej zásady NaOH dôjde k posunu smerom k zníženiu koncentrácie H+.
Koniec práce -
Táto téma patrí do sekcie:
Elektrónové oblaky orbitálov s rôznymi hodnotami l majú rôzne konfigurácie a tie s rovnakým l majú podobnú konfiguráciu
Moderná kvantová mechanická teória tvrdí, že atóm akéhokoľvek prvku má zložitú štruktúru, kladná časť atómu je kladný náboj.. kvantová teória naznačuje, že energiu elektrónu je možné iba prijať.. takže pri l s je orbitál pre elektrón s akoukoľvek hodnotou hlavného kvantového čísla n je elektrónový oblak obmedzený.
Ak potrebujete ďalší materiál k tejto téme, alebo ste nenašli to, čo ste hľadali, odporúčame použiť vyhľadávanie v našej databáze diel:
Čo urobíme s prijatým materiálom:
Ak bol tento materiál pre vás užitočný, môžete si ho uložiť na svoju stránku v sociálnych sieťach:
| Tweetujte |
Všetky témy v tejto sekcii:
Štruktúra atómov a Pauliho princíp
Pauliho princíp pomáha vysvetliť rôzne fyzikálne javy. Dôsledkom tohto princípu je prítomnosť elektrónových obalov v štruktúre atómu, z ktorých zase vyplývajú rôzne chemické
Základné typy chemických väzieb. Kovalentná väzba. Základné princípy metódy valenčnej väzby. Sigma a Picvalentné väzby
atómy sa môžu navzájom spájať a vytvárať jednoduché aj zložité látky. V tomto prípade sa vytvárajú rôzne typy chemických väzieb: iónové, kovalentné (nepolárne a polárne), kovové
Sp hybridizácia
Vyskytuje sa, keď sa zmieša jedna s- a jedna p-orbitálna. Vytvárajú sa dva ekvivalentné sp-atómové orbitály, umiestnené lineárne pod uhlom 180 stupňov a nasmerované rôznymi smermi od jadra atómu
Geometrický tvar a polarita molekúl
Hybridizácia Geometrický tvar Uhol medzi väzbami sp Lineárny 180° sp
Iónová väzba ako limitujúci prípad polarizácie kovalentnej väzby. Elektrostatická interakcia iónov
Iónová väzba je veľmi silná chemická väzba vytvorená medzi atómami s veľkým rozdielom (>1,5 na Paulingovej stupnici) elektronegativity, pri ktorej zdieľaný elektrónový pár
Chemické vlastnosti základných oxidov
1. Vo vode rozpustné zásadité oxidy reagujú s vodou za vzniku zásad: Na2O + H2O → 2NaOH. 2. Interakcia s oxidmi kyselín, čo spôsobuje
Chemické vlastnosti oxidov kyselín
1. Reagujte s vodou za vzniku kyseliny: SO3 + H2O → H2SO4. Ale nie všetky kyslé oxidy reagujú priamo s vodou (SiO
Chemické vlastnosti amfotérnych oxidov
1. Reagujte s kyselinami za vzniku soli a vody: ZnO + 2HCl → ZnCl2 + H2O. 2. Reagovať s pevnými alkáliami (počas fúzie), čo vedie k tvorbe
Dôvody. Chemické vlastnosti zásad. Amfotérne stavy, reakcie ich interakcie s kyselinami a zásadami
Báza je chemická zlúčenina schopná tvoriť kovalentnú väzbu s protónom (Brønstedova báza
Charakteristické reakcie
Amfotérne oxidy reagujú so silnými kyselinami a vytvárajú soli týchto kyselín. Takéto reakcie sú prejavom základných vlastností amfotérnych oxidov, napr.: ZnO + H2SO4
Kyseliny. Anoxické a kyslíkaté kyseliny. Vlastnosti kyselín (sírová, chlorovodíková, dusičná)
Kyseliny sú komplexné látky, ktorých molekuly pozostávajú z nahraditeľných atómov vodíka a kyslých zvyškov. Kyslý zvyšok má záporný náboj.
Kyselina sírová
Kyselina sírová H2SO4 je silná dvojsýtna kyselina zodpovedajúca najvyššiemu oxidačnému stavu síry (+6). Za normálnych podmienok koncentrovaná kyselina sírová
Dusičnany
Kyselina dusičná je silná kyselina. Jej soli – dusičnany – sa získavajú pôsobením HNO3 na kovy, oxidy, hydroxidy alebo uhličitany. Všetky dusičnany sú vysoko rozpustné vo vode. Dusičnanový ión v
Homogénna katalýza
Príkladom homogénnej katalýzy je rozklad peroxidu vodíka v prítomnosti iónov jódu. Reakcia prebieha v dvoch fázach: H2O2 + I → H2O + IO
Heterogénna katalýza
Pri heterogénnej katalýze k urýchleniu procesu zvyčajne dochádza na povrchu pevného telesa - katalyzátora, preto aktivita katalyzátora závisí od veľkosti a vlastností jeho povrchu. V praxi
Vplyv koncentrácie na rýchlosť chemickej reakcie. Zákon masovej akcie
Aby látky reagovali, musia sa ich molekuly zraziť. Pravdepodobnosť, že sa dvaja ľudia zrazia na rušnej ulici, je oveľa vyššia ako na opustenej. To isté s molekulami. Je zrejmé, že v
Vplyv teploty na rýchlosť chemickej reakcie. Aktivačná energia
Vplyv teploty na počet molekulárnych zrážok je možné ukázať pomocou modelu. Pri prvej aproximácii je vplyv teploty na rýchlosť reakcie určený van’t Hoffovým pravidlom (formulovaným
Reakcie bez a s účasťou elektrónov. Iónová výmena a redoxné reakcie
Valenčné elektróny určujú správanie chemického prvku pri chemických reakciách. Čím menej valenčných elektrónov prvok má, tým ľahšie sa týchto elektrónov vzdáva (vykazuje vlastnosti redukcie
Obrázok iónomeničových reakcií
Výmennú reakciu v roztoku zvyčajne reprezentujú tri rovnice: molekulárna, plne iónová a skrátená iónová. V iónovej rovnici sú slabé elektrolyty, plyny a slabo rozpustné látky reprezentované m
Pravidlá zápisu iónomeničových reakcií
Pri písaní iónových rovníc by ste sa mali riadiť tabuľkou rozpustnosti kyselín, zásad a solí vo vode, to znamená, že nezabudnite skontrolovať rozpustnosť činidiel a produktov.
Oxidácia
Oxidácia je proces straty elektrónov so zvýšením stupňa oxidácie. Keď je látka oxidovaná, jej oxidačný stav sa zvyšuje v dôsledku straty elektrónov. O
zotavenie
Redukcia je proces pridávania elektrónov k atómu látky, pričom sa znižuje jej oxidačný stav. Pri redukcii atómov alebo iónov pridávam
Redoxný pár
Oxidačné činidlo a jeho redukovaná forma alebo redukčné činidlo a jeho oxidovaná forma tvoria konjugovaný redoxný pár a ich vzájomné premeny sú oxidačné v
Typy redoxných reakcií
Intermolekulové - reakcie, pri ktorých sa oxidačné a redukčné atómy nachádzajú v molekulách rôznych látok, napr.: H2S + Cl2 → S + 2HCl Int.
Oxidácia, redukcia
Pri redoxných reakciách sa elektróny prenášajú z jedného atómu, molekuly alebo iónu na druhý. Proces straty elektrónov je oxidácia. Počas oxidácie sa oxidačný stav zvyšuje:
Interakcia s jednoduchými látkami
Interakcia s kovmi: 2Na + Cl2 = 2NaCl, Fe + S = FeS, 6Li + N2 = 2Li3N, 2Ca + O2
Hmotnostný zlomok
Hmotnostný zlomok je pomer hmotnosti rozpustenej látky k hmotnosti roztoku. Hmotnostný zlomok sa meria v zlomkoch jednotky alebo v percentách:
Molalita (koncentrácia molárnej hmotnosti, molárna koncentrácia)
Molalita je množstvo rozpustenej látky (počet mólov) v 1000 g rozpúšťadla. Výraz "molalita", meraný v móloch na kg, je tiež bežný. Takže roztok s koncentráciou 0.
Titer roztoku
Hlavný článok: Roztokový titer Roztokový titer je hmotnosť rozpustenej látky v 1 ml roztoku.
Rozpustnosť. Rovnováha v heterogénnych systémoch. Produkt rozpustnosti slabo rozpustných anorganických látok
Rozpustnosť je schopnosť látky vytvárať s inými látkami homogénne sústavy – roztoky, v ktorých je látka vo forme jednotlivých atómov, iónov, molekúl resp.
Vodné roztoky elektrolytov. Silné a slabé elektrolyty. Konštantný a stupeň disociácie. Ostwaldov zákon riedenia
ROZTOKY ELEKTROLYTOV ROZTOKY ELEKTROLYTOV obsahujú znateľné koncentrácie iónov- katiónov a aniónov vznikajúcich v dôsledku elektrolytickej disociácie
pH vody
Pre pohodlie sú koncentrácie vyjadrené ako pH a hydroxylové pH.
Disociácia silných elektrolytov. Aktivita iónov v roztokoch. Koeficient aktivity. Pochopenie iónovej sily roztokov
Silné elektrolyty sú chemické zlúčeniny, ktorých molekuly v zriedených roztokoch sú takmer úplne disociované na ióny. Stupeň disociácie takýchto elektrolytov je blízky
Stupeň hydrolýzy
Stupeň hydrolýzy sa vzťahuje na pomer časti soli, ktorá podlieha hydrolýze, k celkovej koncentrácii jej iónov v roztoku. Označené a (alebo hhydr);
Elektródový potenciál. Vzhľad potenciálneho skoku na medzifázovej hranici. Vodíková elektróda. Štandardná vodíková elektróda
Elektródový potenciál je rozdiel v elektrickom potenciáli medzi elektródou a elektrolytom, ktorý je s ňou v kontakte (najčastejšie medzi kovom a roztokom elektrolytu
Elektrochemická korózia kovov v rôznych prostrediach
Kontaktná bimetalová korózia je typ elektrochemickej korózie spôsobenej kontaktom kovov s rôznymi elektródovými potenciálmi v elektrolyte. Súčasne dochádza k korózii kovov
Chemická interakcia kovov s roztokmi obyčajných kyselín a oxidačných kyselín
Kyselina chlorovodíková je technický názov pre kyselinu chlorovodíkovú. Získava sa rozpustením plynného chlorovodíka – HCl – vo vode. Vzhľadom na nízku rozpustnosť vo vode je koncentrácia s
Zriediť kyselinu sírovú
V zriedenom vodnom roztoku kyseliny sírovej väčšina jej molekúl disociuje: H2SO4
Koncentrovaná kyselina sírová
V koncentrovanom roztoku kyseliny sírovej (nad 68%) je väčšina molekúl v nedisociovanom stave, takže síra pôsobí ako oxidačné činidlo
Proces elektrolýzy. Katódové a anodické procesy. Poradie výboja častíc na anóde a katóde v závislosti od hodnoty ich elektródového potenciálu
Elektrolýza je fyzikálny a chemický proces pozostávajúci z uvoľňovania jednotlivých častí rozpustených látok alebo iných látok, ktoré sú výsledkom sekundárnych
Katódové reakcie
Posledná reakcia prebieha s vývojom vodíka. Keď elek
Matematický pohľad
Faradayove zákony možno zapísať nasledovným vzorcom: kde:
Konfigurácia atómov a iónov
Rozpustnosť solí a hydroxidov katiónov, ktorá je základom analytickej klasifikácie, podobne ako všetky ostatné vlastnosti katiónov, funkčne súvisí s polohou zodpovedajúcich prvkov v periodickom cykle.
Typy titrácie
Existujú priame, reverzné a substitučné titrácie. Počas priamej titrácie do roztoku analytu (alikvóta alebo vzorka, titrovaná látka) d
Typy titračnej analýzy
Titračná analýza môže byť založená na rôznych typoch chemických reakcií: acidobázická titrácia - neutralizačné reakcie; redoxné titre
Ekvivalentná molárna hmotnosť látky
Ekvivalenty molárnej hmotnosti sa zvyčajne píšu ako alebo
Ekvivalenčné číslo
Ekvivalenčné číslo z je malé kladné celé číslo, ktoré sa rovná počtu ekvivalentov látky obsiahnutej v 1 mole tejto látky. Faktorový ekvivalent
Vlastnosti štruktúry atómu uhlíka. Anorganické zlúčeniny uhlíka (oxidy, uhličitany a hydrogénuhličitany, karbidy) a ich vlastnosti
Uhlík je základom organických a bioorganických zlúčenín a mnohých polymérov. Väčšina zlúčenín uhlíka patrí k organickým látkam, ale v tejto práci budeme venovať pozornosť
Disociácia vody. Vodíkový index.
IN Oda je veľmi slabý elektrolyt. (Elektrolyt je látka, ktorej roztok alebo tavenina vedie elektrický prúd). Voda sa disociuje (rozpadá) na základné ióny:
H 2 O ↔ H + + OH -
Iónový produkt vody K W = [H+] · [OH-] = 10-14 = konšt (molárna koncentrácia iónov mol/l sa bežne uvádza v hranatých zátvorkách). V praxi sa na určenie prostredia používa vodíkový index. Vodíkový exponent záporný dekadický logaritmus molárnej koncentrácie vodíkových iónov: pH= - log [H + ] a je v rozmedzí 0<рН<14
|
Ióny v roztoku |
streda |
pH |
|
[H+] > [OH -] |
Kyslé |
pH< 7 |
|
[H+] = [OH-] = 10-7 mol/l |
Neutrálne |
pH = - log [H+] = - logio-7 = - (-7) = 7 |
|
[OH - ] > [H+] |
Alkalický |
pH > 7 |
|
Kde |
pH |
Kde |
pH |
|
žalúdka |
Dážď |
5,5-6,5 |
|
|
črevá |
8,5 - 9 |
Voda z vodovodu |
6-6,5-7 |
|
kožené |
5,5 -6 |
Morská voda |
8-8,5 |
|
krvi |
7,35-7,45 |
Pôda |
4-10 |
Hydrolýza
Interakcia iónov solí s iónmi vody, ktorá mení hodnotu pH, sa nazýva hydrolýza. Toto je reverzibilná reakcia.
Ak sa pH po rozpustení soli nezmení (pH = 7 zostane), potom nenastane hydrolýza.
Prítomnosť slabého iónu v soli spôsobuje hydrolýzu - je to slabý ión, ktorý na seba naviaže opačne nabitý vodný ión, čím sa vytvorí Nový častice (s nábojom alebo bez neho) a zvyšný vodný ión organizuje médium: H+ - kyslé, OH − - zásadité.
Silné elektrolyty.
|
Silné kyseliny |
Silné dôvody |
|
HCl ↔ H + + Cl − |
NaOH↔ Na + + OH − |
|
H 2 SO 4 ↔ 2 H + + SO 4 2− |
KOH↔ K + + OH − |
|
HNO 3 ↔ H + + NO 3 − |
Ak v tabuľke nie je žiadna častica, potom bude slabá častica (slabý ión).
Soľ sa skladá z katiónu (kladný ión) a aniónu (záporný ión):
Ja + n K.O. -n (zvyšok kyseliny)
Existujú 4 možné kombinácie solí: 1. silná + a silná −
2. silné + a slabé −
3. slabé + a silné −
4.slabé + a slabé −
Uvažujme reakcie s nasledujúcimi variáciami iónov:
1. NaCl + H20 nedochádza k hydrolýze, pretože v soli nie sú žiadne slabé častice a pH sa nemení (rovná sa 7)
silný + silný
reakcia je neutrálna a ide disociácia na ióny: NaCl + H 2 O ↔ Na + + Cl − + H 2 O
2. hydrolýza sódy (technická)
Na 2 CO 3 + H 2 O ↔
Silný + slabý
CO 3 2− + H + OH - ↔ H + CO 3 2− − + OH - alkalické prostredie, pH>7, musíte ďalej písať v molekulárnej forme
Na 2 CO 3 + H 2 O ↔ Na + H + CO 3 2− O + Na + OH - O
3. Hydrolýza síranu zinočnatého
ZnSO 4 + H 2 O ↔
Slabý + silný
Zn +2 + H + OH - ↔ Zn +2 OH - + + H + kyslé prostredie, pH<7, нужно далее написать в молекулярном виде
2 ZnSO 4 +2 H 2 O ↔ (Zn +2 OH - ) + 2 SO 4 2- O + H 2 + SO 4 2- O
4. Hydrolýza uhličitanu hlinitého prebieha úplne, pretože soľ pozostáva z dvoch slabých častíc.
Al 2 (С O 3 ) 3 + 6H 2 O ↔ 2 Al (OH) 3 + 3H 2 CO 3
Elektrochémia
Ak sa kovová platňa vloží do roztoku jej soli, potom sa na rozhraní tuhej a kvapalnej fázy vytvorí dvojitá elektrická vrstva, ktorej hodnota sa odhaduje hodnotou elektródového potenciálu φ. Pre mnohé kovy sa elektródové potenciály určujú pomocou vodíkovej elektródy, ktorej potenciál sa považuje za nulový φ=0. Údaje o potenciáli elektródy sú uvedené v tabuľke č. 3 prílohy v metóde 4/23/2 „Pracovný program a úloha pre test“.
Štandardné elektródové potenciály ( 0 )
niektoré kovy (rozsah napätia) pri 298 K.
|
Polovičná reakcia elektródy |
Polovičná reakcia elektródy |
||
|
Li + (aq.) + 1e - = Li (sol.) |
3.045 |
Cd2+ (aq) + 2e - = Cd (sol) |
0.403 |
|
Rb + (aq) + 1e - = Rb (sol) |
2.925 |
Co2+ (aq) + 2e - = Co (sol) |
0.277 |
|
K + (aq) + 1e - = K (sol) |
2.924 |
Ni2+ (aq) + 2e - = Ni (sol) |
0.250 |
|
Cs + (aq.) + 1e - = Cs (sol.) |
2.923 |
Sn2+ (aq) + 2e - = Sn (sol) |
0.136 |
|
Ba2+ (aq) + 2e - = Ba (sol) |
2.905 |
Pb2+ (aq.) + 2e - = Pb (sol.) |
0.126 |
|
Ca2+ (aq) + 2e - = Ca (sol) |
2.866 |
Fe 3+ (vod.) + 3 e - = Fe (sol.) |
0.037 |
|
Na+ (aq.) + e- = Na (sol.) |
2.714 |
2H+ (aq) + 2e- = H2 (g) |
0.000 |
|
Mg2+ (aq) + 2e - = Mg (sol) |
2.363 |
Sb 3+ (vod.) + 3 e - = Sb (sol.) |
0.200 |
|
Al3+ (aq.) + 3e - = Al (sol.) |
1.663 |
Bi3+ (aq.) + 3e - = Bi (sol.) |
0.215 |
|
Ti2+ (aq) + 2e - = Ti (sol) |
1.630 |
Cu2+ (aq.) + 2e - = Cu (sol.) |
0.337 |
|
Zr4+ (aq.) + 4e - = Zr (sol.) |
1.539 |
Cu + (aq) + e - = Cu (sol) |
0.520 |
|
Mn2+ (aq.) + 2e - = Mn (sol.) |
1.179 |
Ag + (aq.) + e - = Ag (sol.) |
0.799 |
|
V2+ (aq.) + 2e - = V (sol.) |
1.175 |
Hg 2+ (aq) + 2 e - = Hg (l) |
0.850 |
|
Cr2+ (aq) + 2e - = Cr (sol) |
0.913 |
Pd2+ (aq) + 2e - = Pd (sol) |
0,987 |
|
Zn2+ (aq.) + 2e - = Zn (sol.) |
0.763 |
Pt2+ (aq) + 2e - = Pt (sol) |
1,188 |
|
Cr3+ (aq.) + 3e - = Cr (sol.) |
0.744 |
Au 3+ (vod.) + 3 e - = Au (sol.) |
1,498 |
|
Fe 2+ (aq) + 2 e - = Fe (sol) |
0.440 |
Au + (aq.) + e - = Au (sol.) |
1,692 |
Potenciály elektród so znamienkom mínus sa týkajú tých kovov, ktoré vytláčajú vodík z kyselín. V názve tabuľky „Štandardné elektródové potenciály“ zodpovedajú potenciálom stanoveným za štandardných podmienok: teplota t = 25 °C (T = 298 K), tlak P = 1 atm, koncentrácia roztoku, v ktorom je elektróda ponorená C = 1 mol/l. φ 0 --- st. konvenčné
Čím je elektródový potenciál φ nižší, tým je kov aktívnejší, tým väčšie je redukčné činidlo.
Príklad . Ktorý kov je aktívnejší, zinok alebo hliník? Odpoveď: Hliník, keďže jeho potenciál (podľa tabuľky č. 3) je menší ako potenciál zinku.
Galvanické prvky.
Galvanický článok (GC) je zariadenie, v ktorom sa energia chemickej reakcie priamo premieňa na elektrickú energiu. GE pozostáva zo vzájomne prepojených kovových elektród ponorených do roztokov ich solí. Kovové dosky sú spojené pomocou indikačného zariadenia. Polčlánky sú zapojené do elektrického obvodu pomocou trubice naplnenej vodivým roztokom (tzv. soľný mostík). Na obr. Je znázornená schéma medeno-zinkového galvanického článku (Jacobi-Daniel). − Zn / Zn 2+ / / Cu 2+ / Cu +
Zn Cu
- +
ZnSO4 CuSO4
Ryža. 1. Schéma galvanického článku: 1 - elektróda (Zn); 2- nádoba s roztokom ZnSO 4 ; 3 - soľný mostík; 4- nádoba s roztokom CuSO 4; 5- elektróda (Ci).
Hodnoty elektródových potenciálov pre zinok a meď zapíšeme z tabuľky č.3:
0 = 0,337 V 0 = −0,763 V
Cu 2+ / Cu 0 Zn 2+ / Zn 0
Do úvahy prichádza kov s nižším elektródovým potenciálom anóda a tá oxiduje.
Vidíme, že potenciálna hodnota pre zinok je menšia ako pre meď, dospeli sme k záveru, že zinok
anóda (slúži ako záporná elektróda) A Zn 0 - 2ē Zn 2+
Za kov s vyšším elektródovým potenciálom sa považuje atóm a on sa obnovuje.
Reakcia na pravej elektróde pre meď, keďže ide o katódu (funguje ako kladná elektróda), zodpovedá procesu redukcie:
K Cu 2+ + 2ē Cu 0
Galvanické články sú reprezentované nasledujúcim zápisom:
− Zn 0 / ZnSO 4 / / CuSO 4 / Cu 0 + alebo v iónovej forme: − Zn 0 / Zn 2+ / / Cu 2+ / Cu 0
v ktorom zvislé čiary symbolizujú hranicu kov-roztok a dvojitá čiara symbolizuje hranicu medzi roztokmi elektrolytov.
Job GE sa hodnotí podľa hodnoty jeho E.M.F. (najvyššie napätie, ktoré dokáže GE vyprodukovať). EMF galvanického článku je rozdiel medzi elektródovými potenciálmi okysličovadla a reduktora, to znamená, že sa rovná rozdielu medzi elektródovými potenciálmi katódy a anódy.
E = K 0 − A 0 (1) E teor = K vypočítané − A vypočítané
Elektródový potenciál kovu závisí od koncentrácie jeho iónov v roztoku.
Táto závislosť je vyjadrená Nernstovou rovnicou:
kde - štandardný potenciál kovu, R - univerzálna plynová konštanta, T - absolútna teplota, n - číslo pracovné elektróny , prechádzajúci z anódy na katódu, F - Faradayovo číslo 1 F = 96500 C, C - koncentrácia kovových iónov.
Ak vo vyššie uvedenej rovnici nahradíme konštanty R a F ich číselnými hodnotami a prirodzený logaritmus desiatkovým, potom bude mať nasledujúci tvar:
Ak koncentrácie roztokov na elektródach nie sú rovnaké, najskôr vypočítajte nové hodnoty potenciálu pre katódu a anódu, korigované na koncentráciu podľa Nernstovej rovnice a potom ich dosaďte do rovnice (1).
Koncentračný galvanický článok (CGE)pozostáva z dvoch dosiek z toho istého kovu ponorených do roztokov jeho soli, ktoré sa líšia iba koncentráciou. − Zn 0 / Zn 2+ / / Zn 2+ / Zn 0 +
Zn Zn
- +
ZnSO 4 Zn SO 4
C1C2 Ryža. 2. Schéma galvanického článku: 1,5 - elektródy (Zn); 2, 4 - nádoby s roztokom ZnSO 4 ; 3 - soľný mostík.
Elektróda, ktorá je ponorená do roztoku snižšia koncentrácia považovaný za anódu.
Povedzme C 1< С 2 potom ľavá elektróda 1 je anóda a pravá elektróda 2 bude katóda. CGE funguje, kým sa koncentrácie C nevyrovnajú. 1 = C2.
Korózia kovov
Ide o deštrukciu (oxidáciu) kovov pod vplyvom prostredia.
Polarizácia spomalenie korózie v dôsledku tvorby na kovovom povrchu: 1) tenkého filmu neviditeľného pre oči, ktorý zabraňuje ďalšiemu prenikaniu oxidačného činidla; Mám taký film Al, Ti, Zn, Sn, Pb, Mn, Cd, Tl.
2) hrubá vrstva koróznych produktov (viditeľná), čo sťažuje prístup k samotnému kovu. V tomto prípade závisí stupeň polarizácie od pórovitosti tejto vrstvy. Napríklad zelená patina na medi má zloženie ( CuOH)2C03 a jeho pórovitosť je menšia ako u železa (výrobok je hrdza Fe203 nH20 ), preto patina chráni meď lepšie ako hrdza chráni železo.
Depolarizácia zrýchlenie korózie. Existuje vodík a kyslík.
1) Depolarizácia vodíkavyskytuje sa v kyslom prostredí (zriedené kys HCl, H2SO4, HNO3 atď.). Počas elektrochemickej korózie, keďže sa do mnohých kovov zavádzajú prísady legujúcich kovov a vytvárajú sa mikrogalvanické články v dôsledku potenciálnych rozdielov, prostredie sa obnovuje na katóde, to znamená, že sa vodík redukuje z kyseliny:
K 2Н + + 2ē Н 0 2,
a na anóde A oxidácia kovu.
2) Depolarizácia kyslíkavyskytuje sa v neutrálnom a mierne alkalickom prostredí (uvažujeme o atmosférickej korózii)
K2H20 + + O2 + 4ē 4OH −,
A Fe 0 - 2ē Fe 2+ oxidácia železa na Fe 2+ na začiatku korózie, až potom časom dochádza k oxidácii Fe3+.
Produkt korózie Fe (OH) 2 + O 2 → Fe (OH) 3 alebo Fe 2 O 3 · nH 2 O hnedá raž.
ZÁVER: korózia (oxidácia) kovu je vždy anodický proces a médium sa obnovuje na katóde.
Veľa koncentrovaných kyselín pasivovať (zablokovať, výrazne znížiť rýchlosť korózie) veľa kovov. Koncentrovaná kyselina sírová takto pasivuje železo: na povrchu sa vytvorí hustý tenký film FeSO4 , ktorá zabraňuje prenikaniu kyseliny sírovej.
Vplyv hodnoty pH na rýchlosť korózie.
Tabuľka 1 pre kovy Al, Zn, Sn, Pb . Tieto kovy sú stabilné v neutrálnom prostredí vďaka amfoterickosti (v periodickej tabuľke sú medzi pravými kovmi a nekovmi) a produkty korózie reagujú s kyselinami aj zásadami. Preto je potrebné pripraviť vodu na prácu s hliníkovými výmenníkmi tepla (oprava: Al stabilný pri pH=7; Pb pri pH = 8; Sn pri pH=9; charakter krivky je rovnaký).
rýchlosť V KOR
korózia
V KOR
| |
0 7 pH 0 7 pH
Graf 1. Graf 2.
Graf 2 znázorňuje krivku prežľaza: je stabilný vo vysoko alkalickom prostredí.
Spôsoby ochrany kovov pred koróziou.
- Legovaniekovy zavedenie kovových prísad do základného kovu s cieľom získať nové vlastnosti: a) zvýšenie tvrdosti koľajnice, kolesáMn, W, Zn, Cr, Moatď.; b) zvýšená odolnosť proti korózii rôznych druhov nehrdzavejúcej ocele; c) vzhľad plasticity a mäkkosti; d) feromagnetické vlastnosti.
- Úvodinhibítory korózielátky, ktoré znižujú agresivitu prostredia: absorbéry kyslíka v roztokuNa2 SO3 ; katódové moderátory vytvárajú na kove film (chrómany, bichromáty).K2 Cr2 O7 dusitany atď.); Pre kyslé prostredie sa používajú organické zlúčeniny (katapín).
- Nekovové nátery: laky, farby, lubrikanty, vosky, pasty, polyméry, gumy, tvrdá guma. Ochrana gumou a ebonitom sa nazýva gumovanie.
- Elektrochemická ochrana: A)kovové nátery; b) ochrana behúňa; c) katódová ochrana.
- Ochrana proti bludnému prúdu: Predpokladá sa, že 50 % korózie v železničnej doprave vzniká v dôsledku bludných prúdov, sú ovplyvnené všetky časti koľajových vozidiel a to, čo je v zemi. Myšlienkou ochrany je odviesť časť prúdov cez vodiče v zemi, ktoré sú spojené s diódou, ktorá organizuje prechod prúdu v jednom smere (nasávanie).
- Obrana zmikrobiologická korózia: laky a farby na báze polymérov, výmena vzduchu, teplotné podmienky nie vyššie ako 200 C a vlhkosť nie viac ako 80 %, konzervačné prostriedky s použitím inhibítorov, obetná a katodická ochrana.

Ochrana behúňa:ja- oceľová konštrukcia,Katódová ochrana:ja- potiahnuté potrubie,
2- chránič, 3- výplň, 4- elektrický 2- pripojovacie vodiče, 3- zdroj
kontakt so štruktúrou, 5 riadiacich DC, 4 anód.
merací terminál (jaPZOchranný prúd Mechanizmus: elektrolýza
ochrana). Mechanizmus: GE
Ošliapať(anodická) elektrochemická ochrana, na chránenú kovovú konštrukciu je pripevnený chránič - kov szápornejšia hodnota potenciálu elektródy. Aktivitu kovu zvoleného ako ochranu možno posúdiť podľa akčného rádiusu chrániča, t.j. vzdialenosť, cez ktorú presahuje pôsobenie vybraného kovu. Na ochranu behúňa ocele sa najčastejšie používa zinok, ale aj hliník, kadmium a horčík. Polomer ochrany dezénu je približne 50 m.
Pri ochrane káblov, potrubí a iných konštrukcií umiestnených v zemi sa zinkové chráničky inštalujú v zložení plniva: 25% CaSO4 2H2 Oh, 28% Na2 SO4 · 10 N2 Oh, 50% hliny. Chrániče na inštaláciu do zeme sa zvyčajne vyrábajú vo forme valcov. Pre kontakt so spojovacím vodičom, ktorý je zvyčajne spájkovaný, má chránič jadro z pozinkovanej ocele.
Rýchlosť korózie s anodickou ochranou môže byť znížená na minimálnu hodnotu zodpovedajúcu plnému polarizačnému prúdu, ale nikdy nie je znížená na nulu, ako v prípade katódovej ochrany.
Katódaelektrochemická ochrana slúži na ochranu kovových výrobkov nachádzajúcich sa v pôde. Vykonáva sa pripojením kovových konštrukcií k zápornému pólu externého zdroja jednosmerného prúdu. S katódovou ochranouAko pomocná elektróda (anóda) sa používajú nerozpustné materiály (grafit, uhlie) alebo rozpúšťajúci sa kovový šrot (koľajnice, staré potrubia), ktoré je potrebné periodicky obnovovať. V prípade boja proti podzemnej korózii je kladný pól externého zdroja prúdu uzemnený. Dosah katódovej ochrany je asi 2 km.

Ochrana proti bludnému prúdu: jausmerňovacia rozvodňa, 2- vrchná kontaktná sieť, 3- koľajnice, 4- zemina, 5- bludný prúd, 6- potrubie, 7- dióda, 8- kovová prepojka.
Na ochranu podzemných kovových konštrukcií pred zničením bludnými prúdmi sa používaochrana elektrického odvodnenia. Vykonáva sa pripojením anódovej časti podzemnej stavby (potrubia) kovovým vodičom k zdroju bludných prúdov, napríklad koľajnici. Prúd prechádza kovovým vodičom, v dôsledku čoho je eliminovaný potenciálny rozdiel medzi zemou a koľajnicou a tým aj nebezpečenstvo korózie. Keďže prúd na elektrifikovaných železniciach môže často meniť svoj smer, pre väčšiu spoľahlivosť ochrany sa používa polarizovaná elektrická drenáž. K tomu je v kovových spojoch zahrnutý usmerňovač, napríklad kremíková alebo germániová dióda, ktorý zaisťuje, že prúd preteká len v požadovanom smere.
ELEKTROlýza
Ide o premenu látky pod vplyvom elektrického prúdu. Zároveň nakatódasa obnovujúpozitívne častice (katióny)a ďalejanódaoxidovaťnegatívne častice (anióny).
Používa sa pri elektrolýzerozpustný(kovové) anerozpustný(uhlie)elektródy.Rozpustnosť elektród je dôležitá len pre anodický proces. Štandardne sa používajú uhlíkové elektródy.
Faradayov prvý zákon.
Pri prechode množstva elektriny cez roztok alebo taveninu látky 1F= 96500 C sa na katóde a anóde uvoľňuje jeden ekvivalent produktov elektrolýzy.
Druhý Faradayov zákon.
Hmotnosť alebo objem produktu elektrolýzy závisí priamo od sily prúdu, času prechodu elektriny a povahy produktu elektrolýzy.
a
Kdeja prúdová silaA;t čas, s; Eprod hmotnostný ekvivalent, G;EVprod objemový ekvivalent, l.Aktuálny výstup
Elektrolýza sa vyznačuje vysokými hodnotami prúdovej účinnosti: 97-99%.
Elektrolýza sa používa na výrobu vysoko čistých látok, kovov, na povlakovanie, galvanizáciu, galvanoplastiku, separáciu zmesí látok, na elektrokoaguláciu, na výrobu vodíka ako alternatívneho paliva, v katódovej ochrane proti korózii a pod.
Pravidlá písania rovníc elektrolýzy pre vodné roztoky.
- Redukcia katiónov na katóde.
a) Ak je soľný kov v „napäťovej sérii“ ažAlvrátane, potom sa vodík redukuje z vody na katóde a kov zostáva v roztoku:
TO2H+ + 2ē → N0 2
b) Ak je soľný kov v „napäťovej sérii“ odTiaž po H vrátane, potom sa vodík z vody aj kovu redukuje na katóde:
TO2H+ + 2ē → N0 2 ACr3+ + 3ē →Cr0
V)Ak je soľný kov v „napäťovej sérii“ po vodíku, potom sa jeden kov redukuje na katóde:
TOAg+ + 1 ē → Ag0
- Oxidácia aniónov na anóde
A)pre nerozpustné (uhlíkové) elektródy:
S2- , ja- , Br - ,Cl- OH- ,NIE3 - , SO4 2- , P.O.4 3-
zvyšujúce sa ťažkosti s oxidáciou aniónov.
b)pre rozpustné (kovové) elektródy:
anióny soli zostávajú v roztoku arozpustný materiál kovovej anódy oxiduje.
STRANA 7
katión+
anión -
Iónový produkt vody je súčinom koncentrácií vodíkových iónov H+ a hydroxidových iónov OH? vo vode alebo vo vodných roztokoch, konštanta autoprotolýzy vody. Zobrazenie hodnoty iónového produktu vody
Voda, hoci je slabým elektrolytom, disociuje v malom rozsahu:
H2O + H2O - H3O+ + OH? alebo H2O - H+ + OH?
Rovnováha tejto reakcie je výrazne posunutá doľava. Disociačnú konštantu vody možno vypočítať pomocou vzorca:
Koncentrácia hydróniových iónov (protónov);
koncentrácia hydroxidových iónov;
Koncentrácia vody (v molekulárnej forme) vo vode;
Koncentrácia vody vo vode, berúc do úvahy jej nízky stupeň disociácie, je prakticky konštantná a predstavuje (1000 g/l)/(18 g/mol) = 55,56 mol/l.
Pri 25 °C je disociačná konštanta vody 1,8×10×16 mol/l. Rovnicu (1) môžeme prepísať takto: Označme súčin K· = Kw = 1,8×10?16 mol/l · 55,56 mol/l = 10?14mol/l = · (pri 25 °C).
Konštanta Kw, ktorá sa rovná súčinu koncentrácií protónov a hydroxidových iónov, sa nazýva iónový súčin vody. Je konštantná nielen pre čistú vodu, ale aj pre zriedené vodné roztoky látok. So zvyšujúcou sa teplotou sa zvyšuje disociácia vody, teda rastie aj Kw, s klesajúcou teplotou naopak. Praktický význam iónového produktu vody
Praktický význam iónového produktu vody je veľký, pretože umožňuje pri známej kyslosti (alkalite) akéhokoľvek roztoku (teda pri známej koncentrácii alebo ) nájsť zodpovedajúcu koncentráciu alebo . Aj keď vo väčšine prípadov pre pohodlie prezentácie nepoužívajú absolútne hodnoty koncentrácií, ale ich desatinné logaritmy s opačným znamienkom - vodíkový index (pH) a hydroxylový index (pOH).
Pretože Kb je konštanta, po pridaní kyseliny (H+ iónov) do roztoku je koncentrácia hydroxidových iónov OH? padne a naopak. V neutrálnom prostredí = = mol/l. Pri koncentrácii > 10?7 mol/l (resp. koncentrácia< 10?7 моль/л) среда будет кислой; При концентрации >10-7 mol/l (resp. koncentrácia< 10?7 моль/л) -- щелочной.
Elektrolytická disociácia vody. hodnota pH
Voda je slabý amfotérny elektrolyt:
H2O H+ + OH- alebo presnejšie: 2H2O H3O+ + OH-
Disociačná konštanta vody pri 25°C sa rovná: Táto hodnota konštanty zodpovedá disociácii jednej zo sto miliónov molekúl vody, preto koncentráciu vody možno považovať za konštantnú a rovnú 55,55 mol/l (hustota vody 1000 g/l, hmotnosť 1 liter 1000 g, množstvo vodnej látky 1000 g: 18 g/mol=55,55 mol, C=55,55 mol: 1 l = 55,55 mol/l). Potom
Táto hodnota je konštantná pri danej teplote (25°C), nazýva sa iónový súčin vody KW:
Disociácia vody je endotermický proces, preto so zvyšujúcou sa teplotou, v súlade s Le Chatelierovým princípom, sa disociácia zintenzívňuje, iónový produkt sa zvyšuje a dosahuje hodnotu 10-13 pri 100°C.
V čistej vode pri 25 °C sú koncentrácie vodíkových a hydroxylových iónov rovnaké:
10-7 mol/l Roztoky, v ktorých sú koncentrácie vodíkových a hydroxylových iónov rovnaké, sa nazývajú neutrálne. Ak sa do čistej vody pridá kyselina, koncentrácia vodíkových iónov sa zvýši a bude vyššia ako 10-7 mol/l, médium sa okyslí a koncentrácia hydroxylových iónov sa okamžite zmení, takže iónový produkt vody sa zachová. jeho hodnota 10-14. To isté sa stane pri pridávaní zásady do čistej vody. Koncentrácie vodíkových a hydroxylových iónov sú vo vzájomnom vzťahu prostredníctvom iónového produktu, a preto, keď poznáme koncentráciu jedného z iónov, je ľahké vypočítať koncentráciu druhého. Napríklad, ak = 10-3 mol/l, potom = KW/ = 10-14/10-3 = 10-11 mol/l, alebo ak = 10-2 mol/l, potom = KW/ = 10-14 /10-2 = 10-12 mol/l. Koncentrácia vodíkových alebo hydroxylových iónov teda môže slúžiť ako kvantitatívna charakteristika kyslosti alebo zásaditosti média.
V praxi sa nepoužívajú koncentrácie vodíkových alebo hydroxylových iónov, ale indikátory pH vodíka alebo hydroxylové pOH Indikátor pH vodíka sa rovná zápornému dekadickému logaritmu koncentrácie vodíkových iónov:
Hydroxylový index pOH sa rovná zápornému desiatkovému logaritmu koncentrácie hydroxylových iónov:
pOH = - log
Je ľahké to ukázať logaritmom iónového produktu vody, ktorý
pH + pH = 14
Ak je pH prostredia 7, prostredie je neutrálne, ak je menej ako 7, je kyslé a čím je pH nižšie, tým je koncentrácia vodíkových iónov vyššia. pH vyššie ako 7 znamená, že prostredie je alkalické; čím vyššie je pH, tým vyššia je koncentrácia hydroxylových iónov. Čistá voda vedie elektrinu veľmi zle, ale stále má merateľnú elektrickú vodivosť, čo sa vysvetľuje miernou disociáciou vody na vodíkové ióny a hydroxidové ióny. Na základe elektrickej vodivosti čistej vody možno určiť koncentráciu vodíkových a hydroxidových iónov vo vode.
Keďže stupeň disociácie vody je veľmi malý, koncentrácia nedisociovaných molekúl vo vode sa prakticky rovná celkovej koncentrácii vody, preto z výrazu pre disociačnú konštantu vody je polovičná ako pre vodu a zriedenú vodnú. roztokov pri konštantnej teplote, súčin koncentrácií vodíkových iónov a hydroxidových iónov je konštantná hodnota. Táto konštanta sa nazýva iónový produkt vody.
Roztoky, v ktorých sú koncentrácie vodíkových a hydroxidových iónov rovnaké, sa nazývajú neutrálne. Kyslé roztoky obsahujú viac vodíkových iónov, zatiaľ čo alkalické roztoky obsahujú viac hydroxidových iónov. Ale súčin ich koncentrácií je vždy konštantný. To znamená, že ak je známa koncentrácia vodíkových iónov vo vodnom roztoku, potom sa určí aj koncentrácia hydroxidových iónov. Preto stupeň kyslosti aj stupeň zásaditosti roztoku možno kvantitatívne charakterizovať koncentráciou vodíkových iónov:
Kyslosť alebo zásaditosť roztoku možno vyjadriť pohodlnejšie: namiesto koncentrácie vodíkových iónov uveďte jeho desatinný logaritmus s opačným znamienkom. Posledná hodnota sa nazýva vodíkový index a označuje sa pH:. Z toho je zrejmé, že v neutrálnom roztoku pH = 7; v kyslých roztokoch pH<7 и тем меньше, чем кислее раствор; в щелочных растворах рН>7 a čím viac, tým väčšia je alkalita roztoku.
Existujú rôzne metódy merania pH. Približnú reakciu roztoku možno určiť pomocou špeciálnych reaktorov nazývaných indikátory, ktorých farba sa mení v závislosti od koncentrácie vodíkových iónov. Najbežnejšie sú metylová pomaranč, metylová červeň, fenolftaleín a lakmus.