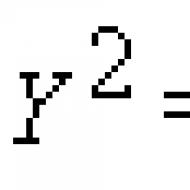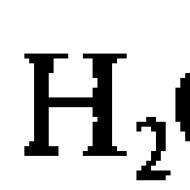Disocijacija vode. pH vrijednost
Čista voda, iako slabo (u usporedbi s otopinama elektrolita), može provoditi električnu struju. To je uzrokovano sposobnošću molekule vode da se raspadne (disocira) na dva iona, koji su vodiči električne struje u čistoj vodi (u nastavku disocijacija znači elektrolitičku disocijaciju - razgradnju na ione): H 2 O ↔ H + + OH -
Za približno 556 000 000 nedisociranih molekula vode, samo 1 molekula disocira, ali to je 60 000 000 000 disociranih molekula u 1 mm3. Disocijacija je reverzibilna, odnosno H + i OH - ioni mogu ponovno formirati molekulu vode. Kao rezultat toga dolazi do dinamičke ravnoteže u kojoj je broj raspadnutih molekula jednak broju nastalih H + i OH - iona. Drugim riječima, brzine oba procesa bit će jednake. Za naš slučaj, jednadžba za brzinu kemijske reakcije može se napisati na sljedeći način:
υ 1 = κ 1 (za disocijaciju vode)
υ 2 = κ 2 (za obrnuti proces)
gdje je υ brzina reakcije; κ je konstanta brzine reakcije (ovisno o prirodi reaktanata i temperaturi); , i - koncentracije (mol/l).
U stanju ravnoteže υ 1 = υ 2, dakle: κ 1 = κ 2
Budući da su pri određenoj temperaturi veličine koje se koriste za izračunavanje ionskog produkta vode (K, ) konstantne, konstantna je i vrijednost ionskog produkta vode. A budući da disocijacijom molekule vode nastaje isti broj iona i , ispada da će za čistu vodu koncentracije i biti jednake 10 -7 mol/l. Iz postojanosti ionskog umnoška vode proizlazi da ako se broj H + iona povećava, onda se broj HO - iona smanjuje. Na primjer, ako se u čistu vodu doda jaka kiselina HCl, ona će, kao jak elektrolit, potpuno disocirati na H + i Cl -, kao rezultat toga, koncentracija H + iona će se naglo povećati, a to će dovesti do povećanje brzine procesa suprotno od disocijacije, jer ovisi o koncentraciji iona H + i OH -: υ 2 = κ 2
Tijekom ubrzanog procesa suprotnog od disocijacije, koncentracija HO - iona smanjit će se na vrijednost koja odgovara novoj ravnoteži, pri kojoj će ih biti toliko malo da će brzine disocijacije vode i obrnutog procesa opet biti jednake. Ako je koncentracija dobivene otopine HCl 0,1 mol/l, ravnotežna koncentracija bit će jednaka: = 10 -14 /0,1 = 10 -13 mol/l
Ionski produkt vodé je umnožak koncentracija vodikovih iona H + i hidroksilnih iona OH − u vodi ili u vodenim otopinama, konstanta autoprotolize vode.
Voda, iako slab elektrolit, u maloj mjeri disocira:
Ravnoteža ove reakcije je jako pomaknuta ulijevo. Konstanta disocijacije vode može se izračunati pomoću formule:
· - koncentracija hidronijevih iona (protona);
· - koncentracija hidroksidnih iona;
· - koncentracija vode (u molekularnom obliku) u vodi;
Koncentracija vode u vodi, uzimajući u obzir njezin nizak stupanj disocijacije, praktički je konstantna i iznosi (1000 g/l)/(18 g/mol) = 55,56 mol/l.
Pri 25 °C konstanta disocijacije vode je 1,8 10 −16 mol/l. Jednadžba (1) se može prepisati kao:
Konstanta K in, jednaka umnošku koncentracija protona i hidroksidnih iona, naziva se ionski produkt vode.. Konstantan je ne samo za čistu vodu, već i za razrijeđene vodene otopine tvari. S porastom temperature raste disocijacija vode, dakle raste i Kv, sniženjem temperature - obrnuto. Praktično značenje ionskog produkta vode je veliko, jer omogućuje, uz poznatu kiselost (lužnatost) bilo koje otopine (to jest, pri poznatoj koncentraciji ili ), pronaći odgovarajuću koncentraciju ili . Iako u većini slučajeva, radi lakšeg prikaza, ne koriste apsolutne vrijednosti koncentracija, već njihove decimalne logaritme uzete s suprotnim predznakom - odnosno indeks vodika (pH) i hidroksilni indeks (pOH).
Kako je Kb konstanta, kada se u otopinu doda kiselina (H + ioni), koncentracija hidroksidnih iona OH − će pasti i obrnuto. U neutralnoj sredini = = mol/l. Pri koncentraciji > 10 -7 mol/l (odnosno, koncentracija< 10 −7 моль/л) среда будет kiselo; Pri koncentraciji > 10 -7 mol/l (odnosno, koncentracija< 10 −7 моль/л) - alkalni.
27. Puferske otopine: njihov sastav, svojstva, mehanizam djelovanja. Kapacitet međuspremnika
Puferske otopine- to su rješenja koja sadrže međuspremnike. Puferski sustavi su smjese koje sadrže slabe kiseline i njihove soli s jakim bazama ili slabe baze i njihove soli s jakim kiselinama u određenom količinskom omjeru. Takve otopine imaju stabilnu koncentraciju H+ iona kada se razrijede neutralnim otapalom (voda) i doda im se određena količina jakih kiselina ili baza.
Puferske otopine nalaze se u vodama svjetskih oceana, otopinama tla i živim organizmima. Ovi sustavi obavljaju funkcije regulatora koji održavaju aktivnu reakciju okoline na određenoj vrijednosti potrebnoj za uspješno odvijanje metaboličkih reakcija. Puferske otopine dijelimo na kisele i bazične. Primjer prvog bio bi acetatni puferski sustav, a primjer potonjeg bi bio amonijev puferski sustav. Postoje prirodna i umjetna rješenja pufera. Prirodna puferska otopina je krv koja sadrži bikarbonatne, fosfatne, proteinske, hemoglobin i kiselinske puferske sustave. Otopina umjetnog pufera može biti acetatni pufer koji se sastoji od CH3COOH.
Razmotrimo značajke unutarnjeg sastava i mehanizma djelovanja puferskih sustava na primjeru acetatnog puferskog sustava: acetatna kiselina/natrijev acetat. U vodenom okruženju komponente puferskog sustava podliježu elektrolitičkoj disocijaciji. Natrijev acetat, kao sol slabe kiseline i jake baze, potpuno disocira na ione. Prisutnost aniona u takvoj puferskoj smjesi ovisi o koncentraciji soli u njoj i stupnju njezine disocijacije. Koncentracija H+ iona u puferskom sustavu izravno je proporcionalna koncentraciji kiseline u njemu i obrnuto proporcionalna sadržaju soli te kiseline u njemu.
Dakle, koncentracija H+ iona u glavnom puferu izravno je proporcionalna koncentraciji soli u njemu i obrnuto proporcionalna koncentraciji baze.
Na primjer, potrebno je pripremiti acetatni pufer s nekoliko pH vrijednosti. Najprije pripremite 5M otopine octene kiseline i natrijeva acetata. Za pripremu prve otopine uzmite 50 ml svake komponente. Vodeći se formulom odredite koncentraciju H+ iona u dobivenoj otopini.
Za sljedeću pufersku otopinu uzmite 80 ml otopine kiseline i 20 ml prethodno pripremljene otopine soli. Postoji niz recepata za različite puferske otopine koje se koriste u kemijskoj analizi i laboratorijskoj praksi.
Puferske otopine karakteriziraju određena svojstva. To prije svega uključuje puferiranje - sposobnost održavanja konstantne koncentracije H+ iona kada se u pufersku otopinu doda određena količina jake kiseline ili jake baze. Na primjer, ako se acetatnom puferu doda mala količina kloridne kiseline, pH se neće pomaknuti na kiselu stranu, jer će kloridna kiselina proći reakciju razgradnje izmjene sa soli slabe kiseline. Kao rezultat reakcije, jaka kiselina koja može pomaknuti pH na kiselu stranu zamijenjena je slabom kiselinom i neutralnom soli. Stupanj disocijacije slabe otopine elektrolita smanjuje se s povećanjem njegove koncentracije, teži nuli i ne dolazi do pomaka pH.
Kapacitet puferske otopine(s engleskog pufer- amortizer, engl polirati- omekšavanje šokova) - količina kiseline ili baze potrebna za promjenu pH otopine pufera za točno 1.
Puferska smjesa, puferska otopina, puferski sustav- kombinacija tvari, sustav koji održava konstantan pH.
Voda- slabi amfoterni elektrolit.
Jednadžba za ionizaciju vode uzimajući u obzir hidrataciju vodikovih iona H + je sljedeća:
Bez uzimanja u obzir hidratacije H + iona, jednadžba disocijacije vode ima oblik:
![]()
Kao što se vidi iz druge jednadžbe, koncentracije vodikovih iona H + i hidroksidnih iona OH - u vodi su iste. Pri 25 o C [H + ] = [OH - ] = 10 -7 mol/l.
Umnožak koncentracija vodikovih iona i hidroksidnih iona naziva se ionski produkt vode(KH2O).
K H 2 O = ∙
K H 2 O je konstantna vrijednost, a na temperaturi od 25 o C
K H 2 O = 10 -7 ∙10 -7 = 10 -14
U razrijeđenim vodenim otopinama elektrolita, kao i u vodi, umnožak koncentracija vodikovih iona H + i hidroksidnih iona OH - konstantna je vrijednost pri određenoj temperaturi. Ionski produkt vode omogućuje svakoj vodenoj otopini izračunavanje koncentracije hidroksidnih iona OH – ako je poznata koncentracija vodikovih iona H+, i obrnuto.
Okoliš bilo koje vodene otopine može se karakterizirati koncentracijom vodikovih iona H + ili hidroksidnih iona OH -.
U vodenim otopinama postoje tri vrste medija: neutralni, alkalni i kiseli.
Neutralno okruženje je medij u kojem je koncentracija vodikovih iona jednaka koncentraciji hidroksidnih iona:
[H+] = = 10 -7 mol/l
Kisela sredina je medij u kojem je koncentracija vodikovih iona veća od koncentracije hidroksidnih iona:
[H + ] > [OH - ], > 10 -7 mol/l
Alkalna sredina je medij u kojem je koncentracija vodikovih iona manja od koncentracije hidroksidnih iona:
< , < 10 -7 моль/л
Za karakterizaciju okruženja otopine prikladno je koristiti takozvanu pH vrijednost (pH).
pH vrijednost naziva se negativni decimalni logaritam koncentracije vodikovih iona: pH = -log.
Na primjer, ako je = 10 -3 mol/l, tada je pH = 3, medij otopine je kisel; ako je [H + ] = 10 -12 mol/l, tada je pH = 12, medij otopine je alkalan: 
pH je manji od 7, što je otopina kiselija. Ako je pH veći od 7, veća je alkalnost otopine.
Odnos između koncentracije H + iona, pH vrijednosti i okoliša otopine prikazan je na sljedećem dijagramu:

Postoje različite metode za mjerenje pH. Kvalitativno, priroda medija vodenih otopina elektrolita određuje se pomoću indikatora.
Indikatori su tvari koje reverzibilno mijenjaju svoju boju ovisno o okolini otopine, tj. pH otopine.
U praksi se koriste indikatori lakmus, metiloranž (metiloranž) i fenolftalein. Mijenjaju boju u malom pH rasponu: lakmus - u pH rasponu od 5,0 do 8,0; metiloranž - od 3,1 do 4,4 i fenolftalein - od 8,2 do 10,0.
Promjena boje indikatora prikazana je na dijagramu: 
Osjenčana područja pokazuju raspon promjena u boji indikatora.

Osim navedenih pokazatelja koristi se i univerzalni indikator kojim se približno može odrediti pH u širokom rasponu od 0 do 14.
pH vrijednost je od velike važnosti u kemijskim i biološkim procesima, jer se ti procesi, ovisno o prirodi okoliša, mogu odvijati različitim brzinama iu različitim smjerovima.
Stoga je određivanje pH otopina vrlo važno u medicini, znanosti, tehnologiji i poljoprivredi. Promjena pH krvi ili želučanog soka dijagnostički je test u medicini. Odstupanja pH od normalnih vrijednosti, čak i za 0,01 jedinicu, ukazuju na patološke procese u organizmu. Konstantnost koncentracija vodikovih iona H+ jedna je od važnih konstanti unutarnjeg okoliša živih organizama.
Dakle, uz normalnu kiselost, želučani sok ima pH 1,7; pH ljudske krvi je 7,4; slina - 6,9. Svaki enzim funkcionira pri određenoj pH vrijednosti: krvna katalaza pri pH 7 želučani sok pepsin - pri pH 1,5-2; itd.
Čista voda, iako slabo (u usporedbi s otopinama elektrolita), može provoditi električnu struju. To je uzrokovano sposobnošću molekule vode da se raspadne (disocira) na dva iona, koji su vodiči električne struje u čistoj vodi (u nastavku disocijacija označava elektrolitičku disocijaciju - raspad na ione):
H 2 O ↔ H + + OH -
Za približno 556 000 000 nedisociranih molekula vode, samo 1 molekula disocira, ali to je 60 000 000 000 disociranih molekula u 1 mm3. Disocijacija je reverzibilna, odnosno H + i OH - ioni mogu ponovno formirati molekulu vode. Na kraju dođe dinamičan ravnoteža u kojoj je broj raspadnutih molekula jednak broju nastalih H + i OH - iona. Drugim riječima, brzine oba procesa bit će jednake. Za naš slučaj, jednadžba za brzinu kemijske reakcije može se napisati na sljedeći način:
υ 1 = κ 1 (za disocijaciju vode)
υ 2 = κ 2 (za obrnuti proces)
Gdje υ - brzina reakcije; κ - konstanta brzine reakcije (ovisno o prirodi reaktanata i temperaturi); , I - koncentracija (mol/l).
U stanju ravnoteže υ 1 = υ 2, stoga:
κ 1 = κ 2
Napravimo jednostavnu matematiku i dobijemo:
κ 1 /κ 2 = /
κ 1 /κ 2 = K
K- konstanta ravnoteže, au našem slučaju konstanta disocijacije, koja ovisi o temperaturi i prirodi tvari, a ne ovisi o koncentracijama (kao ni κ 1 i κ 2). K za vodu 1,8 10 -16 na 25 °C (referentna vrijednost).
Zbog vrlo malog broja disociranih molekula koncentracija može se uzeti jednaka ukupnoj koncentraciji vode, a ukupna koncentracija vode u razrijeđenim otopinama kao konstantna vrijednost:
=1000(g/l)/18(g/mol)=55,6 mol/l.
Zamjena κ 1 / κ 2 na K i koristeći vrijednost , određujemo čemu je jednak umnožak koncentracija I koji se zove - ionski produkt vode:
K = /55,6 mol/l
1,8 10 -16 55,6 mol/l =
10 -14 =
Budući da, na određenoj temperaturi, količine koje se koriste u izračunavanju ionskog produkta vode ( K, ) su konstantne, vrijednost ionskog produkta vode cijelo vrijeme isto. A budući da disocijacijom molekule vode nastaje isti broj iona I , ispada da je za čistu vodu koncentracija I bit će jednaki 10 -7 mol/l. Iz postojanosti ionskog umnoška vode proizlazi da ako se broj H + iona povećava, onda se broj HO - iona smanjuje. Na primjer, ako se u čistu vodu doda jaka kiselina HCl, ona će, kao jak elektrolit, potpuno disocirati na H + i Cl -, kao rezultat toga, koncentracija H + iona će se naglo povećati, a to će dovesti do povećanje brzine procesa suprotno od disocijacije, jer ovisi o koncentraciji iona H+ i OH-:
υ 2 = κ 2
Tijekom ubrzanog procesa suprotnog od disocijacije, koncentracija HO - iona smanjit će se na vrijednost koja odgovara novoj ravnoteži, pri kojoj će ih biti toliko malo da će brzine disocijacije vode i obrnutog procesa opet biti jednake. Ako je koncentracija dobivene otopine HCl 0,1 mol/l, koncentracija ravnoteže bit će jednako:
= 10 -14 /0,1 = 10 -13 mol/l
Kada se doda jaka baza NaOH, pomak će biti prema smanjenju koncentracije H +.
Kraj posla -
Ova tema pripada odjeljku:
Elektronski oblaci orbitala s različitim vrijednostima l imaju različite konfiguracije, a oni s istim l imaju sličnu konfiguraciju
Moderna kvantno mehanička teorija tvrdi da atom bilo kojeg elementa ima složenu strukturu; pozitivni dio atoma je pozitivan naboj.. kvantna teorija implicira da se energija elektrona može samo primiti.. tako da na l s, orbitala za elektron s bilo kojom vrijednošću glavnog kvantnog broja n, elektronski oblak je ograničen..
Ako trebate dodatne materijale o ovoj temi ili niste pronašli ono što ste tražili, preporučamo pretraživanje naše baze radova:
Što ćemo učiniti s primljenim materijalom:
Ako vam je ovaj materijal bio koristan, možete ga spremiti na svoju stranicu na društvenim mrežama:
| Cvrkut |
Sve teme u ovom odjeljku:
Struktura atoma i Paulijev princip
Paulijevo načelo pomaže objasniti niz fizičkih pojava. Posljedica principa je prisutnost elektronskih ljuski u strukturi atoma, iz koje, zauzvrat, slijedi niz kemijskih
Osnovni tipovi kemijskih veza. Kovalentna veza. Osnovni principi metode valentne veze. Sigma i pikovalentna veza
atomi se mogu međusobno spajati i tvoriti jednostavne i složene tvari. U ovom slučaju nastaju različite vrste kemijskih veza: ionske, kovalentne (nepolarne i polarne), metalne
Sp hibridizacija
Javlja se kada se miješaju jedna s- i jedna p-orbitala. Formiraju se dvije ekvivalentne sp-atomske orbitale, smještene linearno pod kutom od 180 stupnjeva i usmjerene u različitim smjerovima od jezgre atoma
Geometrijski oblik i polaritet molekula
Hibridizacija Geometrijski oblik Kut između veza sp Linearni 180° sp
Ionska veza kao granični slučaj polarizacije kovalentne veze. Elektrostatska interakcija iona
Ionska veza je vrlo jaka kemijska veza nastala između atoma s velikom razlikom (>1,5 na Paulingovoj ljestvici) elektronegativnosti, pri kojoj zajednički elektronski par
Kemijska svojstva bazičnih oksida
1. Bazični oksidi topljivi u vodi reagiraju s vodom pri čemu nastaju baze: Na2O + H2O → 2NaOH. 2. Interakcija s kiselim oksidima, uzrokujući
Kemijska svojstva kiselinskih oksida
1. Reakcija s vodom stvara kiselinu: SO3 + H2O → H2SO4. Ali ne reagiraju svi kiselinski oksidi izravno s vodom (SiO
Kemijska svojstva amfoternih oksida
1. Reagirajte s kiselinama pri čemu nastaju sol i voda: ZnO + 2HCl → ZnCl2 + H2O. 2. Reagirati s krutim alkalijama (tijekom fuzije), što rezultira stvaranjem
Temelji. Kemijska svojstva baza. Amfoterna stanja, reakcije njihove interakcije s kiselinama i lužinama
Baza je kemijski spoj sposoban tvoriti kovalentnu vezu s protonom (Brønstedova baza
Karakteristične reakcije
Amfoterni oksidi reagiraju s jakim kiselinama, stvarajući soli tih kiselina. Takve reakcije su manifestacija osnovnih svojstava amfoternih oksida, na primjer: ZnO + H2SO4
kiseline. Anoksične i kisikove kiseline. Svojstva kiselina (sumporna, solna, dušična)
Kiseline su složene tvari čije se molekule sastoje od zamjenjivih atoma vodika i kiselinskih ostataka. Kiselinski ostatak ima negativan naboj.
Sumporne kiseline
Sumporna kiselina H2SO4 je jaka dvobazna kiselina koja odgovara najvišem oksidacijskom stupnju sumpora (+6). U normalnim uvjetima, koncentrirana sumporna kiselina
Nitrati
Dušična kiselina je jaka kiselina. Njegove soli - nitrati - dobivaju se djelovanjem HNO3 na metale, okside, hidrokside ili karbonate. Svi nitrati su visoko topljivi u vodi. Nitratni ion u
Homogena kataliza
Primjer homogene katalize je razgradnja vodikovog peroksida u prisutnosti iona joda. Reakcija se odvija u dva stupnja: H2O2 + I → H2O + IO
Heterogena kataliza
Kod heterogene katalize ubrzanje procesa obično se događa na površini čvrstog tijela – katalizatora, stoga aktivnost katalizatora ovisi o veličini i svojstvima njegove površine. U praksi
Učinak koncentracije na brzinu kemijske reakcije. Zakon djelovanja mase
Da bi tvari reagirale, njihove se molekule moraju sudariti. Vjerojatnost sudara dvoje ljudi na prometnoj ulici mnogo je veća nego na napuštenoj. Isto je i s molekulama. Očito je da u
Utjecaj temperature na brzinu kemijske reakcije. Energija aktivacije
Učinak temperature na broj molekularnih sudara može se prikazati pomoću modela. U prvoj aproksimaciji, učinak temperature na brzinu reakcije određen je van’t Hoffovim pravilom (formulirano
Reakcije bez i sa sudjelovanjem elektrona. Ionska izmjena i redoks reakcije
Valentni elektroni određuju ponašanje kemijskog elementa u kemijskim reakcijama. Što manje valentnih elektrona element ima, lakše se odriče tih elektrona (pokazuje svojstva reduciranja
Slika reakcija ionske izmjene
Reakcija izmjene u otopini obično se prikazuje s tri jednadžbe: molekularnom, punom ionskom i skraćenom ionskom. U ionskoj jednadžbi slabi elektroliti, plinovi i slabo topive tvari predstavljeni su s m
Pravila za pisanje reakcija ionske izmjene
Pri pisanju ionskih jednadžbi treba voditi računa o tablici topljivosti kiselina, baza i soli u vodi, odnosno provjeriti topljivost reagensa i produkata.
Oksidacija
Oksidacija je proces gubljenja elektrona, uz povećanje stupnja oksidacije. Kada se tvar oksidira, njezino se oksidacijsko stanje povećava kao rezultat gubitka elektrona. Na
Oporavak
Redukcija je proces dodavanja elektrona atomu tvari, pri čemu se njezino oksidacijsko stanje smanjuje. Pri redukciji atoma ili iona dodajem
Redox par
Oksidacijski agens i njegov reducirani oblik, ili redukcijski agens i njegov oksidirani oblik čine konjugirani redoks par, a njihove međusobne pretvorbe su oksidacija u
Vrste redoks reakcija
Međumolekulske - reakcije u kojima se oksidirajući i redukcijski atomi nalaze u molekulama različitih tvari, npr.: H2S + Cl2 → S + 2HCl Int.
Oksidacija, redukcija
U redoks reakcijama elektroni se prenose s jednog atoma, molekule ili iona na drugi. Proces gubitka elektrona je oksidacija. Tijekom oksidacije, oksidacijsko stanje se povećava:
Interakcija s jednostavnim tvarima
Interakcija s metalima: 2Na + Cl2 = 2NaCl, Fe + S = FeS, 6Li + N2 = 2Li3N, 2Ca + O2
Maseni udio
Maseni udio je omjer mase otopljene tvari i mase otopine. Maseni udio se mjeri u dijelovima jedinice ili kao postotak:
Molalitet (koncentracija molarne mase, molalna koncentracija)
Molalitet je količina otopljene tvari (broj molova) u 1000 g otapala. Mjeren u molovima po kg, izraz "molalitet" također je uobičajen. Dakle, otopina koncentracije 0.
Titar otopine
Glavni članak: Titar otopine Titar otopine je masa otopljene tvari u 1 ml otopine.
Topljivost. Ravnoteže u heterogenim sustavima. Produkt topljivosti slabo topljivih anorganskih tvari
Topljivost je sposobnost tvari da s drugim tvarima tvori homogene sustave - otopine u kojima je tvar u obliku pojedinačnih atoma, iona, molekula ili
Vodene otopine elektrolita. Jaki i slabi elektroliti. Konstanta i stupanj disocijacije. Ostwaldov zakon razrjeđenja
OTOPINE ELEKTROLITA OTOPINE ELEKTROLITA sadrže zamjetne koncentracije iona-kationa i aniona nastalih kao rezultat elektrolitičke disocijacije
pH vode
Radi praktičnosti, koncentracije su izražene kao pH i hidroksilni pH.
Disocijacija jakih elektrolita. Aktivnost iona u otopinama. Koeficijent aktivnosti. Razumijevanje ionske jakosti otopina
Jaki elektroliti su kemijski spojevi čije su molekule u razrijeđenim otopinama gotovo potpuno disocirane na ione. Stupanj disocijacije takvih elektrolita je blizu
Stupanj hidrolize
Stupanj hidrolize odnosi se na omjer udjela soli koji je podvrgnut hidrolizi i ukupne koncentracije njezinih iona u otopini. Označava se α (ili hhydr);
Potencijal elektrode. Pojava skoka potencijala na međufaznoj granici. Vodikova elektroda. Standardna vodikova elektroda
Potencijal elektrode je razlika u električnom potencijalu između elektrode i elektrolita koji je s njom u kontaktu (najčešće između metala i otopine elektrolita
Elektrokemijska korozija metala u različitim okolinama
Kontaktna bimetalna korozija je vrsta elektrokemijske korozije uzrokovane kontaktom metala koji imaju različite elektrodne potencijale u elektrolitu. Istodobno, korozija metala
Kemijska interakcija metala s otopinama običnih kiselina i oksidirajućih kiselina
Klorovodična kiselina je tehnički naziv za solnu kiselinu. Dobiva se otapanjem plinovitog klorovodika – HCl – u vodi. Zbog niske topljivosti u vodi, koncentracija sa
Razrijeđena sumporna kiselina
U razrijeđenoj vodenoj otopini sumporne kiseline većina njezinih molekula disocira: H2SO4
Koncentrirana sumporna kiselina
U koncentriranoj otopini sumporne kiseline (iznad 68%) većina molekula je u nedisociranom stanju, pa sumpor djeluje kao oksidacijsko sredstvo
Proces elektrolize. Katodni i anodni procesi. Redoslijed pražnjenja čestica na anodi i katodi ovisno o vrijednosti njihovog elektrodnog potencijala
Elektroliza je fizikalni i kemijski proces koji se sastoji od otpuštanja na elektrodama sastavnih dijelova otopljenih tvari ili drugih tvari koje nastaju sekundarnim
Katodne reakcije
Posljednja reakcija odvija se uz oslobađanje vodika. Kada elek
Matematički pogled
Faradayevi zakoni mogu se napisati kao sljedeća formula: gdje je:
Konfiguracija atoma i iona
Topljivost soli i hidroksida kationa, koja je temelj analitičke klasifikacije, kao i sva druga svojstva kationa, funkcionalno je povezana s položajem odgovarajućih elemenata u periodnom ciklusu.
Vrste titracije
Postoje direktna, reverzna i supstituentna titracija. Tijekom izravne titracije do otopine analita (alikvot ili uzorak, titrirana tvar) d
Vrste titrimetrijske analize
Titrimetrijska analiza može se temeljiti na različitim vrstama kemijskih reakcija: acidobazna titracija - reakcije neutralizacije; redoks titara
Ekvivalentna molarna masa tvari
Ekvivalenti molarne mase obično se pišu kao ili
Broj ekvivalencije
Broj ekvivalencije z je mali pozitivni cijeli broj jednak broju ekvivalenata tvari sadržanih u 1 molu te tvari. Ekvivalent faktora
Značajke strukture ugljikovog atoma. Anorganski spojevi ugljika (oksidi, karbonati i bikarbonati, karbidi) i njihova svojstva
Ugljik je osnova organskih i bioorganskih spojeva te mnogih polimera. Većina ugljikovih spojeva pripada organskim tvarima, no u ovom ćemo radu obratiti pažnju na
Disocijacija vode. Vodikov indeks.
U Oda je vrlo slab elektrolit. (Elektrolit je tvar čija otopina ili talina provodi električnu struju). Voda disocira (raspada) na sastavne ione:
H 2 O ↔ H + + OH -
Ionski produkt vode K W = [H + ] · [OH - ] = 10 -14 = konst (molarna koncentracija iona mol/l uobičajeno je označena u uglatim zagradama). U praksi se za određivanje okoliša koristi vodikov indeks. Vodikov eksponent negativni decimalni logaritam molarne koncentracije vodikovih iona: pH= - log [H + ] i nalazi se unutar 0<рН<14
|
Ioni u otopini |
srijeda |
pH |
|
[H + ] > [OH - ] |
kiselo |
pH< 7 |
|
[H+] = [OH -] = 10 -7 mol/l |
Neutralan |
pH = - log [ H + ] = - log 10 -7 = - (- 7) = 7 |
|
[OH - ] > [H + ] |
Alkalna |
pH > 7 |
|
Gdje |
pH |
Gdje |
pH |
|
trbuh |
Kiša |
5,5-6,5 |
|
|
crijeva |
8,5 - 9 |
Voda iz pipe |
6-6,5-7 |
|
koža |
5,5 -6 |
Morska voda |
8-8,5 |
|
krv |
7,35-7,45 |
Tlo |
4-10 |
Hidroliza
Interakcija iona soli s ionima vode, koja mijenja pH vrijednost, naziva se hidroliza. Ovo je reverzibilna reakcija.
Ako se pH ne promijeni kada se sol otopi (pH = 7 ostaje), tada ne dolazi do hidrolize.
Prisutnost slabog iona u soli uzrokuje hidrolizu - slabi ion je taj koji na sebe veže suprotno nabijen vodeni ion, stvarajući tako novi čestica (sa ili bez naboja), a preostali vodeni ion organizira medij: H+ - kiselo, OH − - alkalno.
Jaki elektroliti.
|
Jake kiseline |
Jaki temelji |
|
HCl ↔ H + + Cl − |
NaOH↔ Na + + OH − |
|
H 2 SO 4 ↔ 2 H + + SO 4 2− |
KOH↔ K + + OH − |
|
HNO 3 ↔ H + + NO 3 − |
Ako nema čestice u tablici, onda će biti slaba čestica (slabi ion).
Sol se sastoji od kationa (pozitivni ion) i aniona (negativni ion):
Ja + n K.O. - n (kiselinski ostatak)
Postoje 4 moguće kombinacije soli: 1. jak + i jak −
2. jak + i slab −
3. slab + i jak −
4.slab + i slab −
Razmotrimo reakcije sa sljedećim varijacijama iona:
1. NaCl + H2O nema hidrolize, jer u soli nema slabih čestica, a pH se ne mijenja (jednako 7)
jak+jak
reakcija je neutralna i ide disocijacija na ione: NaCl + H 2 O ↔ Na + + Cl − + H 2 O
2. hidroliza sode (tehnička)
Na 2 CO 3 + H 2 O ↔
Jak+slab
CO 3 2− + H + OH - ↔ H + CO 3 2− − + OH - alkalna sredina, pH>7, trebate dalje pisati u molekularnom obliku
Na 2 CO 3 + H 2 O ↔ Na + H + CO 3 2− O + Na + OH - O
3. Hidroliza cink sulfata
ZnSO 4 + H 2 O ↔
Slabo+jako
Zn +2 + H + OH - ↔ Zn +2 OH - + + H + kisela sredina, pH<7, нужно далее написать в молекулярном виде
2 ZnSO 4 +2 H 2 O ↔ (Zn +2 OH - ) + 2 SO 4 2- O + H 2 + SO 4 2- O
4. Hidroliza aluminijevog karbonata ide do kraja, jer se sol sastoji od dvije slabe čestice.
Al 2 (SO 3 ) 3 + 6H 2 O ↔ 2Al(OH) 3 + 3H 2 CO 3
Elektrokemija
Ako se metalna ploča stavi u otopinu njegove soli, tada na granici krute i tekuće faze nastaje dvostruki električni sloj čija se vrijednost procjenjuje vrijednošću elektrodnog potencijala φ. Za mnoge metale, elektrodni potencijali određuju se korištenjem vodikove elektrode, za čiji potencijal se pretpostavlja da je nula φ=0. Podaci o potencijalu elektrode prikazani su u Tablici br. 3 Dodatka u Metodi 4/23/2 „Program rada i zadatak za ispitivanje“.
Standardni elektrodni potencijali ( 0 )
neki metali (raspon napona) na 298K.
|
Polureakcija elektrode |
Polureakcija elektrode |
||
|
Li + (vod.) + 1 e - = Li (otop.) |
3.045 |
Cd 2+ (aq) + 2 e - = Cd (sol) |
0.403 |
|
Rb + (aq) + 1 e - = Rb (sol) |
2.925 |
Co 2+ (aq) + 2e - = Co (sol) |
0.277 |
|
K + (aq) + 1 e - = K (sol) |
2.924 |
Ni 2+ (aq) + 2 e - = Ni (sol) |
0.250 |
|
Cs + (vod.) + 1 e - = Cs (otop.) |
2.923 |
Sn 2+ (aq) + 2 e - = Sn (sol) |
0.136 |
|
Ba 2+ (aq) + 2 e - = Ba (sol) |
2.905 |
Pb 2+ (vod.) + 2 e - = Pb (otop.) |
0.126 |
|
Ca 2+ (aq) + 2 e - = Ca (sol) |
2.866 |
Fe 3+ (vod.) + 3 e - = Fe (otop.) |
0.037 |
|
Na + (vod.) + e - = Na (otop.) |
2.714 |
2 H + (aq) + 2 e - = H 2 (g) |
0.000 |
|
Mg 2+ (aq) + 2 e - = Mg (sol) |
2.363 |
Sb 3+ (vod.) + 3 e - = Sb (otop.) |
0.200 |
|
Al 3+ (vod.) + 3 e - = Al (otop.) |
1.663 |
Bi 3+ (vod.) + 3 e - = Bi (otop.) |
0.215 |
|
Ti 2+ (aq) + 2 e - = Ti (sol) |
1.630 |
Cu 2+ (vod.) + 2 e - = C u (otop.) |
0.337 |
|
Zr 4+ (vod.) + 4 e - = Zr (otop.) |
1.539 |
Cu + (aq) + e - = Cu (sol) |
0.520 |
|
Mn 2+ (vod.) + 2 e - = Mn (otop.) |
1.179 |
Ag + (vod.) + e - = Ag (otop.) |
0.799 |
|
V 2+ (vod.) + 2 e - = V (otop.) |
1.175 |
Hg 2+ (aq) + 2 e - = Hg (l) |
0.850 |
|
Cr 2+ (aq) + 2 e - = Cr (sol) |
0.913 |
Pd 2+ (aq) + 2 e - = Pd (sol) |
0,987 |
|
Zn 2+ (vod.) + 2 e - = Zn (otop.) |
0.763 |
Pt 2+ (aq) + 2 e - = Pt (sol) |
1,188 |
|
Cr 3+ (aq) + 3 e - = Cr (kruto) |
0.744 |
Au 3+ (vod.) + 3 e - = Au (otop.) |
1,498 |
|
Fe 2+ (aq) + 2 e - = Fe (sol) |
0.440 |
Au + (vod.) + e - = Au (otop.) |
1,692 |
Potencijali elektroda s predznakom minus odnose se na one metale koji istiskuju vodik iz kiselina. U naslovu tablice “Standardni elektrodni potencijali” odgovaraju potencijalima određenim u standardnim uvjetima: temperatura t = 25 0 C (T = 298 K), tlak P = 1 atm, koncentracija otopine u koju je elektroda uronjena C = 1 mol/l. φ 0 --- st. konvencionalne
Što je niži potencijal elektrode φ, to je metal aktivniji, to je redukcijsko sredstvo veće.
Primjer . Koji je metal aktivniji, cink ili aluminij? Odgovor: Aluminij, budući da je njegov potencijal (prema tablici br. 3) manji od potencijala cinka.
Galvanski elementi.
Galvanski članak (GC) je uređaj u kojem se energija kemijske reakcije izravno pretvara u električnu energiju. GE se sastoji od međusobno povezanih metalnih elektroda uronjenih u otopine njihove soli. Metalne ploče su spojene preko pokaznog uređaja. Polućelije su spojene u električni krug pomoću cijevi ispunjene vodljivom otopinom (tzv. slani most). Na sl. 1. Prikazana je shema bakar-cink galvanskog članka (Jacobi-Daniel). − Zn / Zn 2+ / / Cu 2+ / Cu +
Zn Cu
- +
ZnSO 4 CuSO 4
Riža. 1. Shema galvanskog članka: 1 - elektroda (Zn); 2- posuda s otopinom ZnSO 4 ; 3 - slani most; 4- posuda s otopinom CuSO 4 ; 5- elektroda (Ci).
Zapisujemo vrijednosti elektrodnih potencijala za cink i bakar iz tablice br. 3:
0 = 0,337 V 0 = −0,763 V
Cu 2+ / Cu 0 Zn 2+ / Zn 0
Razmatra se metal s nižim potencijalom elektrode anodu i ona oksidira.
Vidimo da je potencijalna vrijednost za cink manja nego za bakar, zaključujemo da cink
anoda (služi kao negativna elektroda) A Zn 0 - 2ē Zn 2+
Metal koji ima veći potencijal elektrode smatra se atom i on obnavlja se.
Reakcija na desnoj elektrodi za bakar, budući da je to katoda (funkcionira kao pozitivna elektroda), odgovara procesu redukcije:
K Cu 2+ + 2ē Cu 0
Galvanske ćelije su predstavljene sljedećim oznakama:
− Zn 0 / ZnSO 4 / / CuSO 4 / Cu 0 + ili u ionskom obliku: − Zn 0 / Zn 2+ / / Cu 2+ / Cu 0
u kojoj okomite crte simboliziraju granicu metal-otopina, a dvostruka crta simbolizira granicu između otopina elektrolita.
Posao GE se procjenjuje prema vrijednosti njegovog E.M.F.-a (najveći napon koji GE može proizvesti). EMF galvanskog članka razlika je elektrodnih potencijala oksidatora i reduktora, odnosno jednaka je razlici elektrodnih potencijala katode i anode.
E = K 0 − A 0 (1) E teor = K izračunato − A izračunato
Potencijal elektrode metala ovisi o koncentraciji njegovih iona u otopini.
Ova se ovisnost izražava Nernstovom jednadžbom:
gdje je - standardni potencijal metala, R - univerzalna plinska konstanta, T - apsolutna temperatura, n - broj radni elektroni , prolazeći od anode do katode, F - Faradayev broj 1 F = 96500 C, C - koncentracija metalnih iona.
Ako u gornjoj jednadžbi zamijenimo konstante R i F njihovim numeričkim vrijednostima, a prirodni logaritam decimalnim, tada će ona poprimiti sljedeći oblik:
Ako koncentracije otopina na elektrodama nisu iste, tada prvo izračunajte nove vrijednosti potencijala za katodu i anodu, korigirane za koncentraciju prema Nernstovoj jednadžbi, a zatim ih zamijenite u jednadžbu (1).
Koncentracijski galvanski članak (CGE)sastoji se od dvije ploče od istog metala uronjene u otopine njegove soli, koje se razlikuju samo po koncentraciji. − Zn 0 / Zn 2+ / / Zn 2+ / Zn 0 +
Zn Zn
- +
ZnSO 4 Zn SO 4
C 1 C 2 Riža. 2. Shema galvanskog članka: 1,5 - elektrode (Zn); 2, 4 - posude s otopinom ZnSO 4 ; 3 - slani most.
Elektroda koja je uronjena u otopinu samanja koncentracija smatrati anodom.
Recimo C1< С 2 , tada je lijeva elektroda 1 anoda, a desna elektroda 2 bit će katoda. CGE radi dok se koncentracije C ne izjednače. 1 = C 2.
Korozija metala
To je uništavanje (oksidacija) metala pod utjecajem okoliša.
Polarizacija usporavanje korozije zbog stvaranja na površini metala: 1) tankog filma nevidljivog oku, koji sprječava daljnje prodiranje oksidirajućeg sredstva; Imam takav film Al, Ti, Zn, Sn, Pb, Mn, Cd, Tl.
2) debeli sloj proizvoda korozije (vidljiv), što otežava pristup samom metalu. U ovom slučaju, stupanj polarizacije ovisi o poroznosti ovog sloja. Na primjer, zelena patina na bakru ima sastav ( CuOH) 2 CO 3 a poroznost mu je manja nego kod željeza (proizvod je hrđa Fe 2 O 3 nH 2 O ), stoga patina bolje štiti bakar nego što hrđa štiti željezo.
Depolarizacija ubrzanje korozije. Postoje vodik i kisik.
1) Depolarizacija vodikajavlja se u kiselim sredinama (razrijeđene kiseline HCl, H2SO4, HNO3 itd.). Tijekom elektrokemijske korozije, budući da se u mnoge metale unose aditivi za legiranje metala i zbog potencijalnih razlika nastaju mikrogalvanske ćelije, na katodi se obnavlja okolina, odnosno vodik se reducira iz kiseline:
K 2N + + 2ē N 0 2,
i na anodi A oksidacija metala.
2) Depolarizacija kisikajavlja se u neutralnim i blago alkalnim sredinama (razmatramo atmosfersku koroziju)
K 2H 2 O + + O 2 + 4ē 4OH − ,
A Fe 0 - 2ē Fe 2+ oksidacija željeza do Fe 2+ na početku korozije, tek tada s vremenom dolazi do oksidacije Fe3+.
Proizvod korozije Fe (OH) 2 + O 2 → Fe (OH) 3 ili Fe 2 O 3 · nH 2 O smeđa raž.
ZAKLJUČAK: korozija (oksidacija) metala je uvijek anodni proces, a medij se obnavlja na katodi.
Mnoge koncentrirane kiseline pasivizirati (blokirati, oštro smanjiti brzinu korozije) mnogi metali. Na taj način koncentrirana sumporna kiselina pasivizira željezo: na površini se stvara gusti tanki film FeSO4 , koji sprječava prodor sumporne kiseline.
Utjecaj pH vrijednosti na brzinu korozije.
Grafikon 1 za metale Al, Zn, Sn, Pb . Ovi su metali stabilni u neutralnom okruženju zbog amfoternosti (nalaze se između pravih metala i nemetala u periodnom sustavu), a produkti korozije reagiraju i s kiselinama i s lužinama. Dakle, potrebno je pripremiti vodu za rad s aluminijskim izmjenjivačima topline (ispravak: Al stabilan na pH=7; Pb pri pH=8; S n pri pH=9; priroda krivulje je ista).
brzina V KOR
korozija
V KOR
| |
0 7 pH 0 7 pH
Grafikon 1. Grafikon 2.
Grafikon 2 prikazuje krivulju zažlijezda: stabilan je u visoko alkalnim okruženjima.
Metode zaštite metala od korozije.
- Legiranjemetali uvođenje metalnih dodataka u osnovni metal radi dobivanja novih svojstava: a) povećanje tvrdoće tračnica, kotačaMn, W, Zn, Kr, Moitd.; b) povećana otpornost na koroziju raznih vrsta nehrđajućeg čelika; c) pojava plastičnosti i mekoće; d) feromagnetska svojstva.
- Uvodinhibitori korozijetvari koje smanjuju agresivnost okoliša: apsorberi kisika u otopiniNa2 TAKO3 ; katodni moderatori stvaraju film na metalu (kromati, bikromatiK2 Kr2 O7 , nitriti, itd.); Za kisele sredine koriste se organski spojevi (katapin).
- Nemetalni premazi: lakovi, boje, maziva, voskovi, paste, polimeri, gume, tvrda guma. Zaštita gumom i ebonitom naziva se gumiranje.
- Elektrokemijska zaštita: A)metalne prevlake; b) zaštitu gaznog sloja; c) katodna zaštita.
- Zaštita od lutajuće struje: Smatra se da 50% korozije u željezničkom prometu nastaje zbog lutajućih struja, zahvaćeni su svi dijelovi voznog parka i ono što je u zemlji. Ideja zaštite je preusmjeriti dio struje kroz vodilice u zemlji, koje su spojene na diodu, koja organizira prolaz struje u jednom smjeru (usis).
- Obrana odmikrobiološka korozija: lakovi i boje na bazi polimera, izmjena zraka, temperaturni uvjeti ne viši od 200 C i vlažnost ne više od 80%, konzervansi s inhibitorima, žrtvena i katodna zaštita.

Zaštita gaznoga sloja:ja- čelična struktura,Katodna zaštita:ja- obložena cijev,
2- zaštitnik, 3- punilo, 4- električna 2- spojne žice, 3- izvor
kontakt sa strukturom, 5 kontrola DC, 4 anoda.
mjerni terminal (jaPZZaštitna struja Mehanizam: elektroliza
zaštita). Mehanizam: GE
Nagaziti(anodna) elektrokemijska zaštita, zaštitnik se pričvršćuje na zaštićenu metalnu konstrukciju - metal sanegativnija vrijednost potencijala elektrode. Aktivnost metala odabranog kao zaštita može se ocijeniti radijusom djelovanja zaštitnika, tj. udaljenost na koju se prostire djelovanje odabranog metala. Za gaznu zaštitu čelika najčešće se koristi cink, te aluminij, kadmij i magnezij. Radijus zaštite gaznoga sloja je približno 50 m.
Kod zaštite kabela, cjevovoda i drugih objekata koji se nalaze u zemlji, štitnici od cinka ugrađuju se u sastavu punila: 25% CaSO4 2H2 Oh, 28% ne2 TAKO4 · 10 N2 Oh, 50% gline. Štitnici za ugradnju u zemlju najčešće se izrađuju u obliku cilindara. Za kontakt sa spojnom žicom, koja je obično lemljena, zaštitnik ima jezgru od pocinčanog čelika.
Brzina korozije s anodnom zaštitom može se smanjiti na minimalnu vrijednost koja odgovara punoj struji polarizacije, ali se nikada ne smanjuje na nulu, kao u slučaju katodne zaštite.
Katodaelektrokemijska zaštita koristi se za zaštitu metalnih proizvoda koji se nalaze u tlu. Izvodi se spajanjem metalnih konstrukcija na negativni pol vanjskog izvora istosmjerne struje. S katodnom zaštitomNetopivi materijali (grafit, ugljen) ili otpadni metali koji se otapaju (tračnice, stare cijevi) koriste se kao pomoćna elektroda (anoda) koju je potrebno povremeno obnavljati. U slučaju borbe protiv podzemne korozije, pozitivni pol vanjskog izvora struje je uzemljen. Domet katodne zaštite je oko 2 km.

Zaštita od lutajuće struje: jaispravljačka trafostanica, 2- nadzemna kontaktna mreža, 3- tračnice, 4- tlo, 5- lutajuća struja, 6- cjevovod, 7- dioda, 8- metalni premosnik.
Koristi se za zaštitu podzemnih metalnih konstrukcija od uništenja lutajućim strujamaelektrična zaštita odvodnje. Izvodi se spajanjem anodnog dijela podzemne konstrukcije (cijevi) s metalnim vodičem na izvor lutajućih struja, na primjer, tračnicu. Struja prolazi kroz metalni vodič, zbog čega se eliminira potencijalna razlika zemlja-šina, a time i opasnost od korozije. Budući da struja na elektrificiranim željeznicama često može mijenjati smjer, za veću pouzdanost zaštite koristi se polarizirana električna odvodnja. Da biste to učinili, ispravljač, na primjer silicijska ili germanijska dioda, uključuje se u metalne spojeve, koji osigurava da struja teče samo u željenom smjeru.
ELEKTROLIZA
To je transformacija tvari pod utjecajem električne struje. Istovremeno, nakatodaobnavljaju sepozitivne čestice (kationi), i daljeanodaoksidiratinegativne čestice (anioni).
Koristi se u elektrolizitopljiv(metal) inetopljiv(ugljen)elektrode.Topljivost elektrode važna je samo za anodni proces. Standardno se koriste ugljične elektrode.
Faradayev prvi zakon.
Prilikom prolaska određene količine elektriciteta kroz otopinu ili taljevinu tvari 1F= 96500 C, na katodi i anodi oslobađa se jedan ekvivalent produkata elektrolize.
Faradayev drugi zakon.
Masa ili volumen produkta elektrolize izravno ovisi o jakosti struje, vremenu prolaska elektriciteta i prirodi produkta elektrolize.
I,
Gdjeja jakost struje, A;t vrijeme, s; Eproizvod maseni ekvivalent, G;EVproizvod volumetrijski ekvivalent, l.Trenutni izlaz
Elektrolizu karakteriziraju visoke vrijednosti strujne učinkovitosti: 97-99%.
Elektroliza se koristi za proizvodnju tvari visoke čistoće, metala, za prevlačenje, galvanizaciju, elektroformiranje, razdvajanje smjesa tvari, za elektrokoagulaciju, za proizvodnju vodika kao alternativnog goriva, u katodnoj zaštiti od korozije itd.
Pravila za pisanje jednadžbi elektrolize vodenih otopina.
- Redukcija kationa na katodi.
a) Ako je metalna sol u "naponskom nizu" doAluključivo, tada se vodik reducira iz vode na katodi, a metal ostaje u otopini:
DO2H+ + 2ē → N0 2
b) Ako je metalna sol u "naponskom nizu" odTido uključivo H, tada se i vodik iz vode i metala reduciraju na katodi:
DO2H+ + 2ē → N0 2 IKr3+ + 3ē →Kr0
V)Ako je metalna sol u "naponskom nizu" nakon vodika, tada se jedan metal reducira na katodi:
DOAg+ + 1 ē → Ag0
- Oksidacija aniona na anodi
A)za netopljive (ugljične) elektrode:
S2- ,ja- , Br - ,Cl- OH- ,NE3 - ,TAKO4 2- , P.O.4 3-
sve teže oksidacije aniona.
b)za topive (metalne) elektrode:
anioni soli ostaju u otopini imaterijal topljive metalne anode oksidira.
STRANICA 7
kation+
anion −
Ionski umnožak vode umnožak je koncentracija vodikovih iona H+ i hidroksidnih iona OH? u vodi ili u vodenim otopinama, konstantna autoprotoliza vode. Prikaz vrijednosti ionskog produkta vode
Voda, iako slab elektrolit, u maloj mjeri disocira:
H2O + H2O - H3O+ + OH? ili H2O - H+ + OH?
Ravnoteža ove reakcije je jako pomaknuta ulijevo. Konstanta disocijacije vode može se izračunati pomoću formule:
Koncentracija hidronijevih iona (protona);
Koncentracija hidroksidnih iona;
Koncentracija vode (u molekularnom obliku) u vodi;
Koncentracija vode u vodi, uzimajući u obzir njezin nizak stupanj disocijacije, praktički je konstantna i iznosi (1000 g/l)/(18 g/mol) = 55,56 mol/l.
Na 25 °C konstanta disocijacije vode je 1,8×10×16 mol/l. Jednadžba (1) se može prepisati kao: Označimo produkt K· = Kw = 1,8×10?16 mol/l · 55,56 mol/l = 10?14mol/l = · (pri 25 °C).
Konstanta Kw, jednaka umnošku koncentracija protona i hidroksidnih iona, naziva se ionski produkt vode. Konstantan je ne samo za čistu vodu, već i za razrijeđene vodene otopine tvari. S porastom temperature raste disocijacija vode, dakle raste i Kw, s padom temperature obrnuto. Praktično značenje ionskog produkta vode
Praktično značenje ionskog produkta vode je veliko, jer omogućuje, uz poznatu kiselost (lužnatost) bilo koje otopine (to jest, pri poznatoj koncentraciji ili ), pronaći odgovarajuću koncentraciju ili . Iako u većini slučajeva, radi lakšeg prikaza, ne koriste apsolutne vrijednosti koncentracija, već njihove decimalne logaritme uzete s suprotnim predznakom - odnosno indeks vodika (pH) i hidroksilni indeks (pOH).
Kako je Kb konstanta, kada se otopini doda kiselina (H+ ioni), koncentracija hidroksidnih iona OH? će pasti i obrnuto. U neutralnoj sredini = = mol/l. Pri koncentraciji > 10-7 mol/l (odnosno koncentracija< 10?7 моль/л) среда будет кислой; При концентрации >10?7 mol/l (odnosno koncentracija< 10?7 моль/л) -- щелочной.
Elektrolitička disocijacija vode. pH vrijednost
Voda je slabi amfoterni elektrolit:
H2O H+ + OH- ili preciznije: 2H2O H3O+ + OH-
Konstanta disocijacije vode na 25°C jednaka je: Ova vrijednost konstante odgovara disocijaciji jedne od sto milijuna molekula vode, stoga se koncentracija vode može smatrati konstantnom i jednakom 55,55 mol/l (gustoća vode 1000 g/l, masa 1 litre 1000 g, količina vodene tvari 1000g: 18g/mol=55,55 mol, C=55,55 mol: 1 l = 55,55 mol/l). Zatim
Ova vrijednost je konstantna na danoj temperaturi (25°C), naziva se ionski produkt vode KW:
Disocijacija vode je endoterman proces, pa se s porastom temperature, prema Le Chatelierovom principu, disocijacija pojačava, ionski produkt raste i doseže vrijednost od 10-13 na 100°C.
U čistoj vodi pri 25°C koncentracije vodikovih i hidroksilnih iona su jednake:
10-7 mol/l Otopine u kojima su koncentracije vodikovih i hidroksilnih iona jednake nazivamo neutralnim. Ako se čistoj vodi doda kiselina, koncentracija vodikovih iona će se povećati i postati veća od 10-7 mol/l, medij će postati kisel, a koncentracija hidroksilnih iona će se trenutno promijeniti tako da ionski produkt vode ostaje njegova vrijednost od 10-14. Ista stvar će se dogoditi kada dodate lužinu u čistu vodu. Koncentracije vodikovih i hidroksilnih iona međusobno su povezane preko ionskog produkta, stoga je, znajući koncentraciju jednog od iona, lako izračunati koncentraciju drugog. Na primjer, ako je = 10-3 mol/l, tada je = KW/ = 10-14/10-3 = 10-11 mol/l, ili ako je = 10-2 mol/l, tada je = KW/ = 10-14 /10-2 = 10-12 mol/l. Tako koncentracija vodikovih ili hidroksilnih iona može poslužiti kao kvantitativna karakteristika kiselosti ili lužnatosti medija.
U praksi se ne koriste koncentracije vodikovih ili hidroksilnih iona, već vodikovi pH ili hidroksilni pOH indikatori, pH vodikov indikator jednak je negativnom decimalnom logaritmu koncentracije vodikovih iona:
Hidroksilni indeks pOH jednak je negativnom decimalnom logaritmu koncentracije hidroksilnih iona:
pOH = - log
Lako je pokazati uzimajući logaritam ionskog produkta vode koji
pH + pH = 14
Ako je pH okoliša 7, okoliš je neutralan, ako je manji od 7, kisel je, a što je pH niži, koncentracija vodikovih iona je veća. pH veći od 7 znači da je okoliš alkalni; što je pH viši, to je veća koncentracija hidroksilnih iona. Čista voda vrlo slabo provodi struju, ali ipak ima mjerljivu električnu vodljivost, što se objašnjava laganom disocijacijom vode na vodikove ione i hidroksidne ione. Na temelju električne vodljivosti čiste vode može se odrediti koncentracija vodikovih i hidroksidnih iona u vodi.
Budući da je stupanj disocijacije vode vrlo mali, koncentracija nedisociranih molekula u vodi praktički je jednaka ukupnoj koncentraciji vode, dakle, iz izraza za konstantu disocijacije vode, pola pola, ono za vodu i razrijeđenu vodenu otopine pri konstantnoj temperaturi, umnožak koncentracija vodikovih iona i hidroksidnih iona je konstantna vrijednost. Ta se konstanta naziva ionski produkt vode.
Otopine u kojima su koncentracije vodikovih i hidroksidnih iona jednake nazivamo neutralnim. Kisele otopine sadrže više vodikovih iona, dok alkalne otopine sadrže više hidroksidnih iona. Ali umnožak njihovih koncentracija uvijek je konstantan. To znači da ako je poznata koncentracija vodikovih iona u vodenoj otopini, tada se određuje i koncentracija hidroksidnih iona. Stoga se i stupanj kiselosti i stupanj lužnatosti otopine mogu kvantitativno karakterizirati koncentracijom vodikovih iona:
Kiselost ili lužnatost otopine može se izraziti na prikladniji način: umjesto koncentracije vodikovih iona navedite njezin decimalni logaritam, uzet sa suprotnim predznakom. Posljednja vrijednost naziva se vodikov indeks i označava pH:. Iz ovoga je jasno da je u neutralnoj otopini pH = 7; u kiselim otopinama pH<7 и тем меньше, чем кислее раствор; в щелочных растворах рН>7, i što je više, veća je alkalnost otopine.
Postoje različite metode za mjerenje pH. Približna reakcija otopine može se odrediti pomoću posebnih reaktora koji se nazivaju indikatori, čija se boja mijenja ovisno o koncentraciji vodikovih iona. Najčešći su metiloranž, metil crveno, fenolftalein i lakmus.