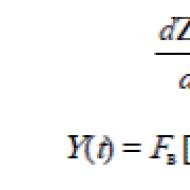
Rezultati Stern eksperimenta. Brzine molekula plina
Predavanje 5
Kao rezultat brojnih sudara molekula plina međusobno (~10 9 sudara u 1 sekundi) i sa stijenkama posude, uspostavlja se određena statistička raspodjela molekula po brzini. U tom slučaju svi smjerovi vektora molekularne brzine pokazuju se jednako vjerojatnim, a moduli brzine i njihove projekcije na koordinatne osi podliježu određenim zakonima.
Tijekom sudara, brzine molekula se nasumično mijenjaju. Može se ispostaviti da će jedna od molekula u nizu sudara dobiti energiju od drugih molekula i da će njezina energija biti znatno veća od prosječne vrijednosti energije na određenoj temperaturi. Brzina takve molekule bit će velika, ali će i dalje imati konačnu vrijednost, budući da je najveća moguća brzina brzina svjetlosti - 3·10 8 m/s. Posljedično, brzina molekule općenito može imati vrijednosti od 0 do neke υ max. Može se tvrditi da su vrlo velike brzine u usporedbi s prosječnim vrijednostima rijetke, kao i vrlo male.
Kao što teorija i eksperimenti pokazuju, raspodjela molekula po brzini nije slučajna, već sasvim određena. Odredimo koliko molekula, odnosno koji dio molekula ima brzine koje leže u određenom intervalu blizu zadane brzine.
Neka određena masa plina sadrži N molekule, dok dN molekule imaju brzine u rasponu od υ prije υ +dυ. Očito je ovo broj molekula dN proporcionalan ukupnom broju molekula N te vrijednost navedenog intervala brzine dυ
Gdje a- koeficijent proporcionalnosti.
Također je očito da dN ovisi o brzini υ , budući da će u intervalima iste veličine, ali pri različitim apsolutnim vrijednostima brzine, broj molekula biti različit (primjer: usporedite broj ljudi koji žive u dobi od 20 - 21 godine i 99 - 100 godina). To znači da koeficijent a u formuli (1) mora biti funkcija brzine.
![]()
Uzimajući to u obzir, prepisujemo (1) u obliku
![]() (2)
(2)
Iz (2) dobivamo
 (3)
(3)
Funkcija f(υ ) naziva se funkcija distribucije. Njegovo fizičko značenje proizlazi iz formule (3)
 ako (4)
ako (4)
Stoga, f(υ ) jednaka je relativnom udjelu molekula čije su brzine sadržane u jediničnom intervalu brzine blizu brzine υ . Preciznije, funkcija raspodjele ima značenje vjerojatnosti da bilo koja molekula plina ima brzinu sadržanu u jedinični interval blizu brzine υ . Zato je zovu gustoća vjerojatnosti.
Integrirajući (2) po svim vrijednostima brzine od 0 do dobivamo
 (5)
(5)
Iz (5) slijedi da
 (6)
(6)
Jednadžba (6) naziva se stanje normalizacije funkcije. Određuje vjerojatnost da molekula ima jednu od vrijednosti brzine od 0 do . Brzina molekule ima neko značenje: ovaj događaj je pouzdan i njegova je vjerojatnost jednaka jedinici.
Funkcija f(υ ) pronašao je Maxwell 1859. Imenovana je Maxwellova distribucija:
 (7)
(7)
Gdje A– koeficijent koji ne ovisi o brzini, m– molekularna masa, T– temperatura plina. Pomoću uvjeta normalizacije (6) možemo odrediti koeficijent A:

Uzimajući ovaj integral, dobivamo A:

Uzimajući u obzir koeficijent A Funkcija Maxwellove distribucije ima oblik:
 (8)
(8)
Prilikom povećanja υ faktor u (8) mijenja se brže nego što raste υ 2. Dakle, funkcija distribucije (8) počinje u ishodištu, doseže maksimum pri određenoj vrijednosti brzine, zatim opada, asimptotski se približava nuli (slika 1).

Sl. 1. Maxwellova raspodjela molekula
po brzini. T 2 > T 1
Koristeći krivulju Maxwellove distribucije, možete grafički pronaći relativni broj molekula čije brzine leže u danom rasponu brzina od υ prije dυ(Sl. 1, područje zasjenjene trake).
Očito, cijela površina ispod krivulje daje ukupan broj molekula N. Iz jednadžbe (2), uzimajući u obzir (8), nalazimo broj molekula čije su brzine u rasponu od υ prije dυ
 (9)
(9)
Iz (8) je također jasno da određeni oblik funkcije distribucije ovisi o vrsti plina (masi molekule m) i temperaturi i ne ovisi o tlaku i volumenu plina.
Ako se izolirani sustav izvede iz ravnoteže i prepusti sam sebi, on će se nakon određenog vremena vratiti u ravnotežu. Ovo vremensko razdoblje naziva se vrijeme opuštanja. Različit je za različite sustave. Ako je plin u stanju ravnoteže, tada se raspodjela molekula po brzini ne mijenja tijekom vremena. Brzine pojedinih molekula stalno se mijenjaju, ali broj molekula dN, čije brzine leže u rasponu od υ prije dυ ostaje konstantan cijelo vrijeme.
Maxwellova raspodjela brzina molekula uvijek se uspostavlja kada sustav postigne stanje ravnoteže. Kretanje molekula plina je kaotično. Točna definicija slučajnosti toplinskog gibanja je sljedeća: kretanje molekula je potpuno kaotično ako su brzine molekula raspoređene prema Maxwellu. Iz toga slijedi da je temperatura određena prosječnom kinetičkom energijom naime kaotični pokreti. Bez obzira kolika je brzina jakog vjetra, neće biti “vruće”. Čak i najjači vjetar može biti i hladan i topao, jer temperatura plina nije određena brzinom smjera vjetra, već brzinom kaotičnog kretanja molekula.
Iz grafa funkcije raspodjele (sl. 1) jasno je da je broj molekula čije brzine leže u istim intervalima d υ , ali blizu različitih brzina υ , više ako je brzina υ približava se brzini koja odgovara maksimumu funkcije f(υ ). Ova brzina υ n naziva se najvjerojatniji (najvjerojatniji).
Diferencirajmo (8) i izjednačimo derivaciju s nulom:

Jer  ,
,
tada je posljednja jednakost zadovoljena kada:

 (10)
(10)
Jednadžba (10) je zadovoljena kada:
I 
Prva dva korijena odgovaraju minimalnim vrijednostima funkcije. Zatim nalazimo brzinu koja odgovara maksimumu funkcije raspodjele iz uvjeta:

Iz posljednje jednadžbe:
 (11)
(11)
Gdje R– univerzalna plinska konstanta, μ - molekulska masa.
Uzimajući u obzir (11) iz (8) možemo dobiti maksimalnu vrijednost funkcije distribucije
 (12)
(12)
Iz (11) i (12) slijedi da s porastom T ili kada se smanjuje m maksimum krivulje f(υ ) pomiče se udesno i smanjuje, ali površina ispod krivulje ostaje konstantna (slika 1).
Za rješavanje mnogih problema prikladno je koristiti Maxwellovu distribuciju u smanjenom obliku. Uvedimo relativnu brzinu:
Gdje υ – dana brzina, υ n- najvjerojatnija brzina. Uzimajući to u obzir, jednadžba (9) ima oblik:
 (13)
(13)
(13) je univerzalna jednadžba. U ovom obliku funkcija distribucije ne ovisi o vrsti plina ili temperaturi.
Zavoj f(υ ) je asimetrična. Iz grafikona (slika 1) jasno je da većina molekula ima brzine veće od υ n. Asimetrija krivulje znači da aritmetička sredina brzine molekula nije jednaka υ n. Aritmetička srednja brzina jednaka je zbroju brzina svih molekula podijeljenom njihovim brojem:

Uzmimo u obzir da prema (2)
![]()
 (14)
(14)
Zamjenjujući u (14) vrijednost f(υ ) iz (8) dobivamo aritmetičku srednju brzinu:
 (15)
(15)
Prosječni kvadrat brzine molekula dobiva se izračunavanjem omjera zbroja kvadrata brzina svih molekula i njihovog broja:

Nakon zamjene f(υ ) iz (8) dobivamo:

Iz zadnjeg izraza nalazimo srednju kvadratnu brzinu:
 (16)
(16)
Uspoređujući (11), (15) i (16), možemo zaključiti da i podjednako ovise o temperaturi i razlikuju se samo u numeričkim vrijednostima: (slika 2).

sl.2. Maxwellova distribucija po apsolutnim vrijednostima brzine
Maxwellova distribucija vrijedi za plinove u stanju ravnoteže; broj razmatranih molekula mora biti dovoljno velik. Za mali broj molekula mogu se uočiti značajna odstupanja od Maxwellove distribucije (fluktuacije).
Prvo eksperimentalno određivanje molekularnih brzina izveo je Stern 1920. godine. Sternov uređaj sastojao se od dva cilindra različitih radijusa, postavljenih na istoj osi. Zrak iz cilindara je ispumpan do dubokog vakuuma. Platinasta nit presvučena tankim slojem srebra bila je rastegnuta duž osi. Kada je kroz žarnu nit propuštena električna struja, ona se zagrijala na visoku temperaturu (~1200 o C), što je dovelo do isparavanja atoma srebra.

U stijenci unutarnjeg cilindra napravljen je uski uzdužni prorez kroz koji su prolazili pokretni atomi srebra. Naneseni na unutarnju površinu vanjskog cilindra, formirali su jasno vidljivu tanku traku točno nasuprot proreza.

Cilindri su se počeli okretati konstantnom kutnom brzinom ω. Sada se atomi koji su prošli kroz prorez više nisu smjestili točno nasuprot proreza, već su se pomaknuli za određenu udaljenost, budući da se tijekom leta vanjski cilindar imao vremena zarotirati za određeni kut. Kad su se cilindri vrtjeli konstantnom brzinom, položaj trake koju čine atomi na vanjskom cilindru pomaknuo se za određenu udaljenost l.

Čestice se talože na točki 1 kada instalacija miruje; kada se instalacija okreće, čestice se talože na točki 2.

Dobivene vrijednosti brzine potvrdile su Maxwellovu teoriju. Međutim, ova je metoda dala približne informacije o prirodi raspodjele brzina molekula.
Maxwellova distribucija točnije je potvrđena eksperimentima Lammert, Easterman, Eldridge i Costa. Ti su pokusi prilično točno potvrdili Maxwellovu teoriju.
Izravna mjerenja brzine atoma žive u snopu napravljena su 1929. godine Lammert. Pojednostavljeni dijagram ovog eksperimenta prikazan je na sl. 3.

sl.3. Dijagram Lammertovog pokusa
1 - brzo rotirajući diskovi, 2 - uski prorezi, 3 - pećnica, 4 - kolimator, 5 - putanja molekula, 6 - detektor
Dva diska 1, postavljena na zajedničku os, imala su radijalne utore 2, pomaknute jedna u odnosu na drugu pod kutom φ . Nasuprot utorima nalazila se peć 3 u kojoj se topljivi metal zagrijavao na visoku temperaturu. Zagrijani atomi metala, u ovom slučaju žive, izletjeli su iz peći i pomoću kolimatora 4 usmjeravali se u željenom smjeru. Prisutnost dva proreza u kolimatoru osiguravala je kretanje čestica između diskova po ravnoj stazi 5. Zatim su atomi koji su prošli kroz proreze u diskovima zabilježeni pomoću detektora 6. Cijela opisana instalacija postavljena je u duboki vakuum .
Kada su diskovi rotirali konstantnom kutnom brzinom ω, samo atomi koji su imali određenu brzinu slobodno su prolazili kroz njihove proreze υ . Za atome koji prolaze kroz oba proreza mora biti zadovoljena jednakost:

gdje je Δ t 1 - vrijeme leta molekula između diskova, Δ t 2 - vrijeme za okretanje diskova pod kutom φ . Zatim:
Promjenom kutne brzine rotacije diskova bilo je moguće izolirati molekule određene brzine od snopa υ , a prema intenzitetu zabilježenom detektorom prosudite njihov relativni sadržaj u snopu.
Na taj je način bilo moguće eksperimentalno provjeriti Maxwellov zakon raspodjele molekulskih brzina.
U drugoj polovici devetnaestog stoljeća proučavanje Brownovog (kaotičnog) gibanja molekula pobudilo je živo zanimanje mnogih teoretskih fizičara tog vremena. Tvar koju je razvio škotski znanstvenik James, iako je bila općeprihvaćena u europskim znanstvenim krugovima, postojala je samo u hipotetskom obliku. Tada nije bilo praktične potvrde za to. Kretanje molekula ostalo je nedostupno izravnom promatranju, a mjerenje njihove brzine činilo se jednostavno nerješivim znanstvenim problemom.
Zato su pokusi koji su mogli u praksi dokazati samu činjenicu molekularne strukture materije i odrediti brzinu kretanja njezinih nevidljivih čestica isprva shvaćeni kao temeljni. Presudna važnost takvih eksperimenata za fizikalnu znanost bila je očita, jer je omogućila dobivanje praktičnog opravdanja i dokaza valjanosti jedne od najnaprednijih teorija tog vremena - molekularne kinetike.
Do početka dvadesetog stoljeća svjetska je znanost dosegla dovoljnu razinu razvoja za pojavu stvarnih mogućnosti za eksperimentalnu provjeru Maxwellove teorije. Njemački fizičar Otto Stern 1920. godine, koristeći metodu molekularne zrake, koju je izumio Francuz Louis Dunoyer 1911. godine, uspio je izmjeriti brzinu kretanja molekula plina srebra. Sternov pokus nepobitno je dokazao valjanost zakona.Rezultati ovog pokusa potvrdili su ispravnost procjene atoma, koja je proizlazila iz hipotetskih pretpostavki Maxwella. Istina, Sternovo iskustvo moglo je pružiti samo vrlo približne informacije o samoj prirodi stupnjevanja brzine. Znanost je morala čekati još devet godina na detaljnije informacije.

Lammert je uspio provjeriti zakon distribucije s većom točnošću 1929. godine, koji je donekle poboljšao Sternov eksperiment propuštanjem molekularne zrake kroz par rotirajućih diskova koji su imali radijalne rupe i bili pomaknuti jedan u odnosu na drugi za određeni kut. Promjenom brzine rotacije jedinice i kuta između rupa, Lammert je uspio izolirati pojedinačne molekule iz snopa koje imaju različite karakteristike brzine. Ali upravo je Sternovo iskustvo postavilo temelje za eksperimentalna istraživanja na polju teorije molekularne kinetike.

Godine 1920. napravljena je prva eksperimentalna instalacija potrebna za izvođenje eksperimenata ove vrste. Sastojao se od para cilindara koje je osobno dizajnirao Stern. Unutar uređaja stavljena je tanka platinasta šipka presvučena srebrom, koja je isparila zagrijavanjem osi strujom. U uvjetima vakuuma koji su stvoreni unutar instalacije, uski snop atoma srebra prošao je kroz uzdužni prorez izrezan na površini cilindara i smjestio se na poseban vanjski ekran. Naravno, jedinica je bila u pokretu, a za vrijeme dok su atomi stigli do površine, uspjela se zarotirati za određeni kut. Na taj je način Stern odredio brzinu njihova kretanja.
Ali to nije jedino znanstveno postignuće Otta Sterna. Godinu dana kasnije, zajedno s Walterom Gerlachom, proveo je eksperiment koji je potvrdio prisutnost spina u atomima i dokazao činjenicu njihove prostorne kvantizacije. Stern-Gerlachov pokus zahtijevao je stvaranje posebne eksperimentalne postavke čija je srž bila snaga. Pod utjecajem magnetskog polja koje je generirala ova moćna komponenta, one su se skrenule prema orijentaciji vlastitog magnetskog spina.
Godina. Pokus je bio jedan od prvih praktičnih dokaza valjanosti molekularne kinetičke teorije strukture tvari. Izravno je mjerio brzinu toplinskog gibanja molekula i potvrdio postojanje raspodjele molekula plina po brzini.
Za provođenje eksperimenta Stern je pripremio uređaj koji se sastojao od dva cilindra različitih polumjera, čija se os poklapala i na koju je bila postavljena platinasta žica presvučena slojem srebra. Kontinuiranim upumpavanjem zraka održavao se dovoljno nizak tlak u prostoru unutar cilindara. Propuštanjem električne struje kroz žicu došlo je do tališta srebra, zbog čega je srebro počelo isparavati, a atomi srebra su ravnomjerno i pravocrtno letjeli na unutarnju površinu malog cilindra brzinom v, određena temperaturom zagrijavanja platinske žice, tj. talištem srebra. U unutarnjem cilindru napravljen je uzak prorez kroz koji su atomi mogli nesmetano letjeti dalje. Stijenke cilindara su posebno ohlađene, što je doprinijelo taloženju atoma koji su padali na njih. U tom stanju, prilično jasna uska traka srebrnog plaka formirana je na unutarnjoj površini velikog cilindra, smještena točno nasuprot proreza malog cilindra. Tada se cijeli sustav počeo okretati određenom dovoljno velikom kutnom brzinom ω . U ovom slučaju, traka plaka pomaknula se u smjeru suprotnom od smjera rotacije i izgubila je svoju jasnoću. Mjerenjem pomaka s najtamnijeg dijela trake iz položaja kada je sustav mirovao, Stern je odredio vrijeme leta, nakon čega je pronašao brzinu kretanja molekula:
,
Gdje s- pomak trake, l- udaljenost između cilindara, i u- brzina kretanja točaka vanjskog cilindra.
Ovako pronađena brzina gibanja atoma srebra podudarala se s brzinom izračunatom prema zakonima molekularne kinetičke teorije, a činjenica da je nastala traka bila zamućena svjedoči o tome da su brzine atoma različite i raspoređene prema određeni zakon - Maxwellov zakon raspodjele: atomi, oni koji se kreću brže pomaknuti su se u odnosu na traku dobivenu u mirovanju za kraće udaljenosti od onih koji se kreću sporije.
Napišite recenziju članka "Stern Experience"
Književnost
- Kratki rječnik fizikalnih pojmova / Comp. A. I. Bolsun, rektor. M. A. Elyashevich. - Mn. : Viša škola, 1979. - Str. 388. - 416 str. - 30.000 primjeraka.
Linkovi
- Landsberg. Elementarni udžbenik fizike. Svezak 1. Mehanika. Toplina. Molekularna fizika. - 12. izd. - M.: FIZMATLIT, 2001. - ISBN 5-9221-0135-8.
- Internet škola Prosveshchenie.ru.(Ruski) (nedostupan link - priča) . Preuzeto 5. travnja 2008.
- Oštro iskustvo- članak iz Velike sovjetske enciklopedije.
Izvadak koji karakterizira Sternov eksperiment
Tako je sada ležao na krevetu, naslonivši svoju tešku, veliku, unakaženu glavu na punašnu ruku, i razmišljao, s jednim otvorenim okom, zureći u tamu.Budući da ga je Bennigsen, koji se dopisivao sa suverenom i imao najveću moć u stožeru, izbjegavao, Kutuzov je bio smireniji u smislu da on i njegove trupe ne bi bili prisiljeni ponovno sudjelovati u beskorisnim ofenzivnim akcijama. Pouka Tarutinske bitke i njezino predvečerje, koje je Kutuzov bolno pamtio, također je trebalo imati učinka, mislio je.
“Moraju shvatiti da možemo izgubiti samo napadački. Strpljenje i vrijeme, to su moji heroji!” – pomisli Kutuzov. Znao je da se ne smije brati jabuka dok je zelena. Sama će pasti kad sazrije, ali ako je ubereš zelenu, pokvarit ćeš i jabuku i stablo, i zube ćeš nabiti. On, kao iskusan lovac, znao je da je životinja ranjena, ranjena kako samo sva ruska vojska može raniti, ali je li smrtonosna ili ne, to je još nerazjašnjeno pitanje. Sada, prema depešama Lauristona i Berthelemyja i prema izvješćima partizana, Kutuzov je gotovo znao da je smrtno ranjen. Ali bilo je potrebno više dokaza, morali smo pričekati.
“Žele pobjeći i vidjeti kako su ga ubili. Čekaj i vidi. Svi manevri, svi napadi! - on je mislio. - Za što? Svi će briljirati. Definitivno ima nečeg zabavnog u borbi. Oni su kao djeca od koje ne možete dobiti razum, kao što je bio slučaj, jer svi žele dokazati kako se mogu boriti. Nije sad u tome poanta.
I kakve mi vješte manevre sve to nudi! Čini im se da su, kad su izmislili dvije-tri nesreće (sjetio se generalnog plana iz Petrograda), sve izmislili. I svima im nema broja!”
Neriješeno pitanje je li rana zadobijena u Borodinu bila smrtonosna ili nije smrtonosna, visilo je nad Kutuzovom glavom cijeli mjesec. S jedne strane, Francuzi su okupirali Moskvu. S druge strane, nedvojbeno je cijelim svojim bićem Kutuzov osjećao da je taj strašni udarac, u koji je on, zajedno sa svim ruskim narodom, napregao sve svoje snage, trebao biti koban. Ali u svakom slučaju bio je potreban dokaz, a on ga je čekao mjesec dana, a što je vrijeme više prolazilo, to je bio nestrpljiviji. Ležeći na krevetu u besanim noćima, činio je ono što su činili ovi mladi generali, ono što im je zamjerao. Smišljao je sve moguće slučajnosti u kojima bi se izrazila ta izvjesna, već izvršena Napoleonova smrt. On je do tih nepredviđenosti dolazio na isti način kao i mladi, samo s tom razlikom što nije ništa temeljio na tim pretpostavkama i što ih je vidio ne dvoje ili troje, nego tisuće. Što je dalje razmišljao, pojavljivalo ih se više. Smišljao je sve vrste pokreta Napoleonove vojske, cijele ili njezinih dijelova - prema Petrogradu, protiv njega, zaobilazeći ga, smišljao je (čega se najviše bojao) i mogućnost da se Napoleon bori protiv s njegovim vlastitim oružjem, da će ostati u Moskvi, čekajući ga. Kutuzov je čak sanjao kretanje Napoleonove vojske natrag prema Medinu i Juhnovu, ali jedno nije mogao predvidjeti bilo je ono što se dogodilo, to ludo, grčevito jurnjanje Napoleonove vojske tijekom prvih jedanaest dana njegova govora iz Moskve - dobacivanje koje je učinilo moguće nešto o čemu se Kutuzov ni tada još nije usuđivao razmišljati: potpuno istrebljenje Francuza. Dorohovljeva izvješća o Broussierovoj diviziji, vijesti od partizana o katastrofama Napoleonove vojske, glasine o pripremama za polazak iz Moskve - sve je potvrđivalo pretpostavku da je francuska vojska poražena i da se sprema u bijeg; ali to su bile samo pretpostavke koje su se činile važnima mladim ljudima, ali ne i Kutuzovu. Sa svojim šezdesetogodišnjim iskustvom znao je kakvu težinu treba pripisati glasinama, znao je koliko su sposobni ljudi koji nešto žele grupirati sve vijesti tako da naizgled potvrđuju ono što žele, i znao je kako u ovom slučaju dragovoljno propustiti sve što proturječi. I što je Kutuzov to više želio, to si je manje dopuštao da u to vjeruje. Ovo je pitanje zaokupilo svu njegovu duševnu snagu. Sve ostalo za njega je bilo samo uobičajeno ispunjenje života. Takvo uobičajeno ispunjenje i podređivanje života bili su njegovi razgovori s osobljem, pisma meni Stael, koja je pisao od Tarutina, čitanje romana, podjela nagrada, dopisivanje sa St. Petersburgom itd. n. Ali smrt Francuza, koju je on sam predvidio, bila je njegova duhovna, jedina želja.
Od formula
dobivamo formulu za izračun srednje kvadratne brzine gibanja molekula jednoatomnog plina:
gdje je R univerzalna plinska konstanta.
Ovisi dakle o temperaturi i prirodi plina. Dakle, na 0°C za vodik je jednaka 1800 m/s. za dušik - 500 m/s.
O. Stern prvi je eksperimentalno odredio brzinu molekula. U komori iz koje je odzračen zrak nalaze se dva koaksijalna cilindra 1 i 2 (slika 1), koji se mogu okretati oko osi konstantnom kutnom brzinom.

Duž osi je zategnuta posrebrena platinasta žica kroz koju prolazi električna struja. Zagrije se i srebro ispari. Atomi srebra ulaze u cilindar 1 kroz prorez 4 u stijenci cilindra 2 i talože se na njegovoj unutarnjoj površini ostavljajući trag u obliku uske trake paralelne s prorezom. Ako su cilindri nepomični, tada se traka nalazi nasuprot utoru (točka B na slici 2, a) i ima istu debljinu.

Kada se cilindar rotira ravnomjerno s kutnom brzinom, traka se pomiče u smjeru suprotnom od rotacije za udaljenost s u odnosu na točku B (slika 2, b). Točka B cilindra 1 pomaknula se za tu udaljenost u vremenu t, što je potrebno da atomi srebra prijeđu udaljenost jednaku R - r, gdje su R i r polumjeri cilindara 1 i 2.
gdje je linearna brzina točaka na površini cilindra 1. Dakle
Brzina atoma srebra
![]()
Poznavajući R, r i eksperimentalno izmjereni s, pomoću ove formule može se izračunati prosječna brzina kretanja atoma srebra. U Sternovom eksperimentu. Ova vrijednost podudara se s teoretskom vrijednošću korijena srednje kvadratne brzine molekula. Ovo služi kao eksperimentalni dokaz valjanosti formule (1), a time i formule (3).
U Sternovom eksperimentu otkriveno je da je širina trake na površini rotirajućeg cilindra mnogo veća od geometrijske slike proreza i da njegova debljina nije ista na različitim mjestima (slika 3, a). To se jedino može objasniti činjenicom da se atomi srebra kreću različitim brzinama. Atomi koji lete određenom brzinom stižu do točke B'. Atomi koji lete brže završavaju u točki koja se na slici 2 nalazi iznad točke B’, a atomi koji lete sporije završavaju ispod točke B’. Dakle, svaka točka na slici odgovara određenoj brzini, koja se lako može odrediti iz iskustva. To objašnjava činjenicu da debljina sloja atoma srebra nataloženog na površini cilindra nije posvuda jednaka. Najveća debljina je u srednjem dijelu sloja, a na rubovima se debljina smanjuje.

Proučavanje oblika poprečnog presjeka trake nataloženog srebra pomoću mikroskopa pokazalo je da ima oblik koji približno odgovara onom prikazanom na slici 3, b. Na temelju debljine nanesenog sloja može se suditi o raspodjeli brzina atoma srebra.
Podijelimo cijeli niz eksperimentalno izmjerenih brzina atoma srebra na male. Neka je jedna od brzina ovog intervala. Koristeći gustoću sloja, izračunavamo broj atoma koji imaju brzinu u rasponu od , i crtamo funkciju
![]()
gdje je N ukupan broj atoma srebra nataloženih na površini cilindra. Dobivamo krivulju prikazanu na slici 4. Zove se funkcija raspodjele brzina molekula.

Područje zasjenjenog područja je
![]()
oni. jednak relativnom broju atoma koji imaju unutarnju brzinu
Vidimo da se brojevi čestica s brzinama iz različitih intervala oštro razlikuju. Postoji neka brzina oko čije se vrijednosti kreću brzine kojima se kreće najveći broj molekula. Ona se zove najvjerojatnija brzina, a odgovara maksimumu na slici 4. Ova krivulja dobro odgovara krivulji koju je dobio J. Maxwell, koji je statističkom metodom teorijski dokazao da u plinovima koji su u stanju termodinam. ravnoteža, određena vrijednost koja se ne mijenja s vremenom, raspodjela molekula po brzini, koja se pokorava točno definiranom statističkom zakonu, grafički prikazanom krivuljom. Najvjerojatnija brzina, kako je pokazao Maxwell, ovisi o temperaturi plina i masi njegovih molekula prema formuli
1 - platinasta žica s nanesenim slojem srebra; 2 - prorez koji tvori snop atoma srebra; 3 - ploča na kojoj su taloženi atomi srebra; P i P1 su položaji nanesenih srebrnih traka kada uređaj miruje i kada se uređaj okreće.
Za provođenje eksperimenta Stern je pripremio uređaj koji se sastojao od dva cilindra različitih polumjera, čija se os poklapala i na koju je bila postavljena platinasta žica presvučena slojem srebra. Kontinuiranim upumpavanjem zraka održavao se dovoljno nizak tlak u prostoru unutar cilindara. Propuštanjem električne struje kroz žicu došlo je do tališta srebra, zbog čega je srebro počelo isparavati, a atomi srebra su ravnomjerno i pravocrtno letjeli na unutarnju površinu malog cilindra brzinom v (\displaystyle v), određena temperaturom zagrijavanja platinske žice, odnosno talištem srebra. U unutarnjem cilindru napravljen je uzak prorez kroz koji su atomi mogli nesmetano letjeti dalje. Stijenke cilindara su posebno ohlađene, što je doprinijelo taloženju atoma koji su padali na njih. U tom stanju, prilično jasna uska traka srebrnog plaka formirana je na unutarnjoj površini velikog cilindra, smještena točno nasuprot proreza malog cilindra. Tada se cijeli sustav počeo okretati određenom dovoljno velikom kutnom brzinom ω (\displaystyle \omega ). U ovom slučaju, traka plaka pomaknula se u smjeru suprotnom od smjera rotacije i izgubila je svoju jasnoću. Mjerenjem pomaka s (\displaystyle s) najtamnijeg dijela trake iz položaja kada je sustav mirovao, Stern je odredio vrijeme leta, nakon čega je pronašao brzinu kretanja molekula:
t = s u = l v ⇒ v = u l s = ω R b i g (R b i g − R s m a l l) s (\displaystyle t=(\frac (s)(u))=(\frac (l)(v))\Rightarrow v =(\frac (ul)(s))=(\frac (\omega R_(veliki)(R_(veliki)-R_(mali)))(s))),Gdje s (\displaystyle s)- pomak trake, l (\displaystyle l)- udaljenost između cilindara, i u (\displaystyle u)- brzina kretanja točaka vanjskog cilindra.
Tako pronađena brzina gibanja atoma srebra (584 m/s) podudarala se s brzinom izračunatom prema zakonima molekularne kinetičke teorije, a činjenica da je dobivena traka bila zamućena svjedoči o tome da su brzine atoma bile različite. su različiti i raspoređeni prema nekom zakonu – Maxwellov zakon distribucije: atomi koji su se gibali brže bili su pomaknuti u odnosu na traku dobivenu u mirovanju za manje udaljenosti od onih koji su se gibali sporije. Istodobno, iskustvo je dalo samo približne informacije o prirodi Maxwellove distribucije; točnija eksperimentalna potvrda datira iz 1930.