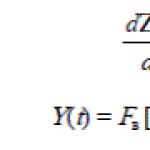
Kemija (građa atoma) (prezentacija). Osnove atomske strukture
Test br. 1 “Građa atoma. Periodni sustav. Kemijske formule"
Zakirova Olisya Telmanovna – učiteljica kemije.
MBOU "Arskaya prosjek opće obrazovanje škola № 7 "
Cilj: Provjeriti dosljednost, snagu, dubinu znanjana temu “Građa atoma. Periodni sustav. Kemijske formule". Kontrolirati stupanj usvojenih znanja o strukturi atoma, sposobnost karakterizacije elementa po položaju u PSCE-u te određivanje molekulske mase spojeva.
1. faza. Organiziranje vremena. 1.Pozdrav.
2. Organizacija radnih mjesta.
3. Objavljivanje svrhe sata učenicima
Postavljanje cilja lekcije:
Ponavljanje, uopćavanje i usustavljivanje pojmova.PZ i PSE D. I. Mendeljejev
2. faza: Ponavljanje, generalizacija i sistematizacija pojmova
Opcija 1.
1. Što određuje mjesto kemijskog elementa u PSCE D. I. Mendelejeva?
A) broj elektrona u atomu B) broj elektrona na vanjskoj razini C) broj neutrona u atomskoj jezgri;
D) broj protona u atomskoj jezgri; D) nema točnog odgovora.
2. Što određuje svojstva kemijskih elemenata?A) vrijednost relativne atomske mase;B) naboj atomske jezgre;C) broj elektrona na vanjskoj razini;D) broj elektrona u atomu; E) nema točnog odgovora.
3. Kako se može odrediti broj elektroničkih razina u atomu bilo kojeg kemijskog elementa?
4. Kako se može odrediti broj elektrona u vanjskom sloju atoma elemenata glavnih podskupina?
A) po broju razdoblja; B) po broju skupine; C) po broju retka; D) nema točnog odgovora.
5. Kako se mijenja radijus atoma s povećanjem atomskog broja elementa u periodi?
A) povećava se; B) smanjuje; C) ne mijenja se; D) nema uzorka u promjenama.
6. Atom kojeg od navedenih elemenata ima najveći radijus?
A) berilij; B) bor; B) ugljik; D) dušik.
7. Odredite molekulsku masuCO2 ; H2 TAKO4
opcija 2.
1. Kako se mijenjaju svojstva kemijskih elemenata s povećanjem nuklearnog naboja?
A) metalna svojstva se povećavaju B) metalna svojstva se periodički ponavljaju;
C) poboljšana su nemetalna svojstva; D) nema točnog odgovora.
2. Koji element ima najizraženija metalna svojstva: A) silicij; B) aluminij; C) natrij; D) magnezij.
3. Kako se mijenjaju svojstva elemenata u glavnim podskupinama periodnog sustava s povećanjem naboja jezgre?
A) metalna svojstva slabe; B) metalna svojstva se ne mijenjaju;
C) nemetalna svojstva se ne mijenjaju; D) nema točnog odgovora.
4. Koji element ima najizraženija nemetalna svojstva?A) sumpor;B) kisik;C) selen;D) telur.
5. Što određuje mjesto kemijskog elementa u PSHE D. I. Mendeljejeva?A) masa atoma;B) naboj atomske jezgre;
C) broj elektrona u vanjskoj razini; D) broj elektroničkih razina atoma; E) nema točnog odgovora.
6. Brojem periode u kojoj se nalazi kemijski element možete odrediti: A) broj elektrona u atomu;
B) broj elektrona u vanjskoj elektronskoj razini C) najveću valenciju elementa;
D) broj elektroničkih razina u atomu; D) nema točnog odgovora.
7. Odredite molekulsku masuCO ; H2 TAKO3
Opcija 3.
1. Što određuje svojstva kemijskog elementa? A) broj elektrona u atomu; B) broj elektroničkih razina u atomu; C) broj neutrona u atomskoj jezgri; D) ne postoji točan odgovor .
2. Brojem skupine u kojoj se nalazi atom možete odrediti: A) broj elektrona u atomu;
B) broj elektrona u vanjskoj elektronskoj razini u atomu bilo kojeg elementa u skupini;
C) broj elektrona u vanjskoj elektronskoj razini u atomu elementa glavne podskupine dane skupine;
D) broj elektroničkih razina u atomu; D) nema točnog odgovora.
3. Kako se mijenja polumjer atoma u periodi s povećanjem atomskog broja elementa?
A) ne mijenja se; B) povećava se; C) smanjuje; D) periodički se ponavlja.
4. Kako se mijenjaju svojstva kemijskih elemenata s povećanjem naboja jezgre?A) metalna svojstva slabe;B) metalna svojstva se periodički ponavljaju;C) nemetalna svojstva slabe;
D) nemetalna svojstva ponavljaju se povremeno; D) nema točnog odgovora.
5. Kako se mijenjaju svojstva elemenata u glavnim podskupinama PSHE D.I. Mendeljejeva s rastućim nuklearnim nabojem?
A) poboljšana su metalna svojstva B) poboljšana su nemetalna svojstva;
C) svojstva se ne mijenjaju; D) nema točnog odgovora.
6. Koji element ima najizraženija nemetalna svojstva?
A) germanij; B) arsen; C) brom; D) selen.
7. Odredite molekulsku masuH2 O ; H3 P.O.4
Faza 3: Sažimanje lekcije.
KONTROLNI RAD br. 1 Tema “Građa atoma” 11. razred
opcija 1
1. Broj razdoblja u periodnom sustavu određuje se:
A. Naboj jezgre atoma
B. Broj elektrona u vanjskom sloju atoma.
B. Broj slojeva elektrona u atomu
D. Broj elektrona u atomu.
A. S i Cl B. Be i B C. Kr i Xe D. Mo i Se
3. p – Element je:
A. Skandij.
B. Barij.
B. Arsen
G. Helij
10 4s 2 odgovara elementu:
A. Kalcij.
B. Kripton.
V. Kadmij.
G. Zinku.
A. Zn(OH) 2
B. Mg(OH) 2
B. Ca(OH) 2
G. Cr(OH) 2
A.Mg – Ca – Zn.
B.Al – Mg – Ca.
B.Sr – Rb – K.
G.Ge - Si - Sb.
2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 1
A.E 2 O
B.E 2 O 3
V.EO 2
G.EO 3
8. Izotop kalcija, čija jezgra sadrži 22 neutrona, označava se:
A. 20 40 Ca
B. 20 42 SaV. 20 44 Ca
G. 20 48 Ca
9. Podudaranje:
Element:
- Aluminij. II. Kalij. III. Selen. IV. Magnezij.
Elektronska formula:
A.1s 2 2s 2 2p 6 3s 2 3p 1
B.1s 2 2s 2 2p 6 3s 2
B.1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 4
G.1s 2 2s 2 3s 2 3p 6 4s 1
Superiorna oksidna formula:
- E 2 O 2.E 2 O 3 3.EO 4.EO 3
Formula višeg hidroksida:
A. EON. b. E(OH)2. V. E(OH) 3 g. N2 EO 4
10. Na temelju njihovog položaja u periodnom sustavu poredajte elemente: germanij, arsen, sumpor, fosfor - prema silaznom redoslijedu oksidacijskih svojstava. Objasni svoj odgovor.
11. Kako i zašto se mijenjaju svojstva metala u periodnom sustavu?
A. Unutar razdoblja.
B. Unutar glavne podskupine.
12. Napravite elektroničku formulu za element s atomskim brojem 30 u periodnom sustavu. Zaključite je li taj element metal ili nemetal. Napiši formule njegovih viših oksida i hidroksida, označi njihovu prirodu.
13. Koja su kemijska svojstva karakteristična za najviši oksid elementa 3. periode, glavne podskupine VI skupine periodnog sustava? Svoj odgovor potvrdite ispisivanjem jednadžbi reakcije.
Test br. 1 Tema “Građa atoma” 11. razred
opcija 2
- Broj skupine (za elemente glavnih podskupina) u periodnom sustavu određuje:
A. Broj protona u atomu.
B. Broj elektrona u vanjskom sloju atoma.
B. Broj elektronskih slojeva u atomu.
D. Broj neutrona u atomu.
2. Par elemenata koji imaju sličnu strukturu vanjske i predvanjske energetske razine:
A.Ba i K B.Ti i Ge
B.Sb i Bi G.Kr i Fe
3. p – Element je:
A. Kalij
B. Silicij
V.Argon
G. Bakar
4. Elektronička konfiguracija. . .3d 5 4s 2 odgovara elementu:
A. Brom
B. Kalcij
V. Marganets
G. Klor
5. Amfoterni oksid je tvar čija je formula:
A. CrO B. Cr 2 O 3 C. CrO 3 D. FeO
6. Niz elemenata poredanih prema rastućim metalnim svojstvima:
A. Al – Ga – Ge.
B. Ca – Sr – Ba.
B. K–Na–Li.
G. Mg - Ca – Zn.
7.Element E s elektronskom formulom 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 3 nastaje viši oksid koji odgovara formuli:
A.EO
B.E 2 O 3
V.E 2 O 5
G.EO 3
8. Izotop željeza, čija jezgra sadrži 30 neutrona, označava se:
A. 26 54 Fe
B. 26 56 Fe
V. 26 57 Fe
G. 26 58 Fe
9. Podudaranje:
Element:
- Bor. II. Brom. III. Fosfor. IV. Litij.
Elektronska formula:
A.1s 2 2s 2 2p 1
B.1s 2 2s 1
B. 1s 2 2s 2 2p 6 3s 2 3p 3
G. 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 5
Superiorna oksidna formula:
- E 2 O 2.E 2 O 3 3.E 2 O 5 4.E 2 O 7
Formula višeg hidroksida:
A. EON. b. NEO 3. V. N 3 EO 3 NEO 4
DIO B. Pitanja sa slobodnim odgovorom
10. Na temelju njihovog položaja u periodnom sustavu poredajte elemente: aluminij, kalij, kalcij, magnezij – po rastućim redukcijskim svojstvima. Objasni svoj odgovor.
11. Zašto se naboji jezgri atoma elemenata poredanih u rastućem redoslijedu rednih brojeva u periodnom sustavu mijenjaju monotono, a svojstva elemenata periodički?
12. Napravite elektroničku formulu za element s rednim brojem 38 u periodnom sustavu. Zaključite je li taj element metal ili nemetal. Napiši formule njegovih viših oksida i hidroksida, označi njihovu prirodu.
13. Koja su kemijska svojstva karakteristična za metalne hidrokside? Svoj odgovor potvrdite ispisivanjem jednadžbi reakcije.
Opcija 3
1. Ukupan broj elektrona u atomu elementa određuje se pomoću periodnog sustava, prema broju:
A. Grupe.
B. Razdoblje.
V. red.
G. Poryadkovoy.
2. Par elemenata koji imaju sličnu strukturu vanjske i predvanjske energetske razine:
A. Sn i Si B. As i Se C. Zn i Ca D. Mo i Te
3. f – Element je:
A. Germanij.
B. Kalij.
V. Selen.
G. Uran.
4. Elektronička konfiguracija. . .4s 2 4p 6 odgovara elementu:
A. Brom.
B. Žlijezda.
V.Neon.
G. Kripton.
5. Amfoterni hidroksid je tvar čija je formula:
A. Ga(OH) 3.
B. Mg(OH) 2.
B. LiOH.
G. Sc(OH) 2
6. Niz elemenata poredanih prema rastućim metalnim svojstvima:
A. K – Rb – Sr.
B.Al – Mg – Ca.
B. Be –– Li - Cs.
G.Ge - Sn – Sb.
7.Element E s elektronskom formulom 1s 2 2s 2 2p 6 3s 1 nastaje viši oksid koji odgovara formuli:
A.E 2 O
B.E 2 O 3
V.EO 2
G.EO 3
8. Izotop kalcija, čija jezgra sadrži 24 neutrona, označava se:
A. 20 40 Ca
B. 20 42 Ca
V. 20 44 Ca
G. 20 48 Ca
9. Podudaranje:
Element:
- Dušik. II. Kalcij. III. Silicij. IV. Sumpor.
Elektronska formula:
A.1s 2 2s 2 2p 3
B.1s 2 2s 2 2p 6 3s 2 3p 4
B.1s 2 2s 2 2p 6 3s 2 3p 2
G.1s 2 2s 2 3s 2 3p 6 4s 2
Superiorna oksidna formula:
- EO 2.EO 2 3.E 2 O 5 4.EO 3
Formula višeg hidroksida:
A. N 2 OE 4 . b. E(OH)2. V. N 2 EO 3 NEO 3
DIO B. Pitanja sa slobodnim odgovorom
10. Na temelju njihovog položaja u periodnom sustavu poredajte elemente: kisik, arsen, sumpor, fosfor - prema silaznom redoslijedu oksidacijskih svojstava. Objasni svoj odgovor.
11. Navedite temeljna pravila (zakone) prema kojima elektroni ispunjavaju razine, podrazine i orbitale u elektronskoj ovojnici atoma elemenata.
12. Izradite elektroničku formulu za element s rednim brojem 34 u periodnom sustavu. Zaključite je li taj element metal ili nemetal. Napiši formule njegovih viših oksida i hidroksida, označi njihovu prirodu.
13. Koja su kemijska svojstva karakteristična za hidrokside nemetala? Svoj odgovor potvrdite ispisivanjem jednadžbi reakcije.
opcija 1
Dio A.
A 1. Nastaje jezgra atoma (39 K).
1) 19 protona i 20 elektrona 2) 20 neutrona i 19 elektrona
3) 19 protona i 20 neutrona 4) 19 protona i 19 neutrona
A 2. Elektronska formula odgovara atomu elementa fosfora
1) 1S 2 2S 2 2p 6 3S 2 3p 2 2) 1S 2 2S 2 2p 6 3S 2 3p 3 3) 1S 2 2S 2 2p 6 3S 2 3p 4 4) 1S 2 2S 2 2p 6 3S 2 3p 5
A 3. Kemijski elementi poredani su u opadajućem redoslijedu svojih atomskih radijusa
1) Ba, Cd, Sb 2) In, Pb, Sb 3) Cs, Na, H 4) Br, Se, As
A 4. Jesu li sljedeće tvrdnje o kemijskim elementima točne?
A. Svi kemijski elementi-metali pripadaju S- i d-elementima.
B. Nemetali u spojevima pokazuju samo negativna oksidacijska stanja.
A 5. Među metalima glavne podskupine skupine II najjači redukcijski agens je
1) barij 2) kalcij 3) stroncij 4) magnezij
A 6. Broj energetskih slojeva i broj elektrona u vanjskom energetskom sloju atoma kroma jednaki su, respektivno
A 7. Viši kromov hidroksid pokazuje
A 8. Elektronegativnost elemenata raste slijeva nadesno u nizu
1) O-S-Se-Te 2) B-Be-Li-Na 3) O-N-P-As 4) Ge-Si-S-Cl
A 9. Oksidacijsko stanje klora u Ba(ClO 3) 2 jednako je
1) +1 2) +3 3) +5 4) +7
A 10. Element arsen pripada
Odgovori na zadatak B1-B2
U 1. Povećanje kiselih svojstava viših oksida događa se u sljedećim serijama:
1) CaOSiO 2 SO 3 2) CO 2 Al 2 O 3 MgO 3) Li 2 OCO 2 N 2 O 5
4) As 2 O 5 P 2 O 5 N 2 O 5 5) BeOCaOSrO 6) SO 3 P 2 O 5 Al 2 O 3
U 2. Podudaranje.
Sastav jezgre Elektronska formula
A. 7 p + 1, 7 n 0 1 1. 2S 2 2 p 3
B. 15 p + 1, 16 n 0 1 2. 2S 2 2p 4
B. 9 p + 1, 10 n 0 1 3. 3S 2 3p 5
G. 34 p + 1, 45 n 0 1 4. 2S 2 2p 5
od 1. Napiši formulu za viši oksid i viši hidroksid broma. Napišite elektroničku konfiguraciju atoma broma u osnovnom i pobuđenom stanju, odredite njegove moguće valencije.
Napišite elektroničke formule za atom broma u najvećoj i najmanjoj potenciji.
Test br. 1 na temu "Struktura atoma"
opcija 2
Dio A. Izaberite jedan točan odgovor
A 1. Broj protona, neutrona i elektrona izotopa 90 Sr je redom jednak
1. 38, 90, 38 2. 38, 52, 38 3. 90, 52, 38 4. 38, 52,90
A 2. Elektronska formula 1S 2 2S 2 2p 6 3S 2 3p 6 4S 1 odgovara atomu elementa
1. sumpor 2. brom 3. kalij 4. mangan
A 3. Elementi su raspoređeni prema opadajućem atomskom radijusu
1) bor, aluminij, galij 3) bor, ugljik, silicij
2) kalij, natrij, litij 4) kripton, ksenon, radon
A 4. Jesu li sljedeći sudovi o promjenama svojstava elemenata u nizu točni?
Be-Mg-Ca-Sr-Ba?
A. Metalna svojstva su poboljšana.
B. Polumjer atoma i broj valentnih elektrona se ne mijenjaju.
1) samo je A točno 2) samo je B točno 3) oba suda su točna 4) oba suda su netočna
A 5. Među nemetalima treće periode najjači oksidans je
1) fosfor 2) silicij 3) sumpor 4) klor
A 6. Broj energetskih slojeva i broj elektrona u vanjskom energetskom sloju atoma mangana jednaki su, respektivno
1) 4, 2 2) 4, 1 3) 4, 6 4) 4, 5
A 7. Viši mangan hidroksid pokazuje
1) kisela svojstva 3) bazična svojstva
2) amfoterna svojstva 4) ne pokazuje acidobazna svojstva
A 8. Elektronegativnost elemenata opada slijeva nadesno u nizu
1) O-Se-S-Te 2) Be-Be-Li-H 3) O-N-P-As 4) Ge-Si-S-Cl
A 9. Oksidacijsko stanje dušika u Ba(NO 2) 2 jednako je
1) +1 2) +3 3) +5 4) +7
A 10. Element mangan pripada
1) s-elementi 2) p-elementi 3) d-elementi 4) prijelazni elementi
Odgovori na zadatak B1-B2 je niz brojeva koji odgovara brojevima točnih odgovora.
U 1. Povećanje osnovnih svojstava viših hidroksida događa se u redovima njihovih sastavnih elemenata:
1) MgAl ) AsR 3) PSCl
4)BBeLi 5) MgCaBa 6)CaKCs
U 2. Podudaranje.
Sastav jezgre Elektronska formula
A. 19 r + 1, 20 n 0 1 1. 4S 1
B. 20 r + 1, 20 n 0 1 2. 4S 2
B. 14 p + 1, 14 n 0 1 3. 5S 1
G. 35 r + 1, 45 n 0 1 4. 4S 2 4p 5
Prilikom rješavanja zadatka C 1 detaljno zapišite tijek rješavanja i dobiveni rezultat.
od 1. Napiši formulu za viši oksid i viši hidroksid arsena. Napišite elektroničku konfiguraciju atoma arsena u osnovnom i pobuđenom stanju, odredite njegove moguće valencije.
Napišite elektroničke formule za atom arsena u maksimalnoj i minimalnoj potenciji.
laboratorijski radovi
praktične nastave
samostalan rad u razredu
samostalna zadaća (standardni račun)
kontrolni (obrane, kolokviji, kolokviji, kolokviji, ispiti)
Udžbenici i lekcije
N.V.Korovin. opća kemija
Tečaj opće kemije. Teorija i problemi (priredili N.V. Korovin, B.I. Adamson)
N. V. Korovin i dr. Laboratorijski rad u kemiji
Kalendarski plan
elektroliti, |
||||||||||||||||||||
Kemijski ekvivalent |
||||||||||||||||||||
hidroliza, PR |
||||||||||||||||||||
Električni oblik- |
13(2 ) |
|||||||||||||||||||
GE, elektroliza, |
||||||||||||||||||||
27(13,16) |
14(2 ) |
|||||||||||||||||||
korozija |
||||||||||||||||||||
Kvantni brojevi |
||||||||||||||||||||
17(2 ) |
||||||||||||||||||||
18(2 ) |
||||||||||||||||||||
Kemijska veza |
||||||||||||||||||||
Kompleksi |
||||||||||||||||||||
Termodinamika |
||||||||||||||||||||
Kinetika. |
||||||||||||||||||||
6(2,3 ) |
||||||||||||||||||||
Ravnoteža |
||||||||||||||||||||

Uvod u kemiju
Kemija je na Energetskom institutu temeljna općeteorijska disciplina.
Kemija je prirodna znanost koja proučava sastav, strukturu, svojstva i pretvorbe tvari, kao i pojave koje te pretvorbe prate.
M.V. Lomonosov |
D.I.Mendeljejev |
|||||||
“Kemijski |
||||||||
“Osnove kemije” 1871 |
||||||||
razmatra |
Svojstva |
|||||||
g.) – “Kemija – |
||||||||
promjene |
||||||||
doktrina elemenata i |
||||||||
objašnjava |
||||||||
njihove veze." |
||||||||
kemijski |
||||||||
događaju se transformacije.”
“Zlatno doba kemije” (kraj 19. i početak 20. stoljeća)
Periodički zakon D.I.Mendelejeva (1896.)
Pojam valencije koji je uveo E. Frankland (1853.)
Teorija strukture organskih spojeva A.M. Butlerova (1861.-1863.)
A. Wernerova teorija kompleksnih spojeva
Zakon djelovanja mase M. Gultberga i L. Waagea
Termokemiju je uglavnom razvio G.I. Hess
Teorija elektrolitičke disocijacije S. Arrheniusa
Načelo pokretne ravnoteže A. Le Chateliera
J.W. Gibbsovo fazno pravilo
Bohr-Sommerfeldova teorija složene strukture atoma (1913.-1916.)

Značaj današnjeg stupnja razvoja kemije
Razumijevanje zakona kemije i njihova primjena omogućuje stvaranje novih procesa, strojeva, instalacija i uređaja.
Dobivanje električne energije, goriva, metala, raznih materijala, hrane i dr. izravno povezani s kemijskim reakcijama. Na primjer, električna i mehanička energija trenutno se uglavnom dobivaju pretvorbom kemijske energije prirodnih goriva (reakcije izgaranja, interakcija vode i njezinih nečistoća s metalima itd.). Bez razumijevanja ovih procesa nemoguće je osigurati učinkovit rad elektrana i motora s unutarnjim izgaranjem.
Poznavanje kemije potrebno je za:
- formiranje znanstvenog svjetonazora,
- za razvoj maštovitog mišljenja,
- kreativni razvoj budućih stručnjaka.
Sadašnju fazu razvoja kemije karakterizira široka uporaba kvantne (valne) mehanike za tumačenje i izračunavanje kemijskih parametara tvari i sustava tvari, a temelji se na kvantnomehaničkom modelu strukture atoma.

Atom je složeni elektromagnetski mikrosustav koji ima svojstva kemijskog elementa.
GRAĐA ATOMA
Izotopi su varijante atoma iste kemikalije
elementi koji imaju isti atomski broj, ali različite atomske brojeve
Mr (Cl) = 35*0,7543 + 37*0,2457 = 35,491

Osnovni principi kvantne mehanike
Kvantna mehanika- ponašanje pokretnih mikroobjekata (uključujući elektrone) – ovo je
istodobno očitovanje i svojstava čestica i svojstava valova – dualna (korpuskularno-valna) priroda.
Kvantizacija energije: Max Planck (1900., Njemačka) –
tvari emitiraju i apsorbiraju energiju u diskretnim dijelovima (kvantima). Kvantna energija proporcionalna je frekvenciji zračenja (oscilacije) ν:
h – Planckova konstanta (6,626·10-34 J·s); ν=s/λ, s – brzina svjetlosti, λ – valna duljina
Albert Einstein (1905.): svako zračenje je tok energetskih kvanta (fotona) E = m v 2
Louis de Broglie (1924., Francuska): također je karakteriziran elektrončestica-valdualnost - zračenje se širi kao val i sastoji se od malih čestica (fotona)
Čestica – m, |
mv, E = mv 2 |
||||
Val - , |
E 2 = h = hv / |
||||
Povezana valna duljina s masom i brzinom: |
|||||
E1 = E2; |
H/mv |
||||
nesigurnost |
Werner Heisenberg (1927. |
||||
Njemačka) |
raditi |
neizvjesnosti |
odredbe |
||
(koordinate) |
čestice x i |
impuls (mv) ne |
Može biti |
||
manje od h/2
x (mv) h/2 (- pogreška, nesigurnost) tj. Položaj i zamah čestice fundamentalno je nemoguće odrediti u bilo kojem trenutku s apsolutnom točnošću.

Elektronski oblak Atomska orbitala (AO)
Da. točna lokacija čestice (elektrona) zamijenjena je konceptom statističke vjerojatnosti da se ona nađe u određenom volumenu (blizu nuklearnog) prostora.
Kretanje e- ima valni karakter i opisano je
2 dv - gustoća vjerojatnosti pronalaska e- u određenom volumenu blizu nuklearnog prostora. Ovaj prostor se zove atomska orbitala (AO).
Godine 1926. Schrödinger je predložio jednadžbu koja matematički opisuje stanje e - u atomu. Rješavajući to
pronaći valnu funkciju. U jednostavnom slučaju, to ovisi o 3 koordinate
Elektron nosi negativan naboj, njegova orbitala predstavlja određenu raspodjelu naboja i naziva se elektronski oblak
KVANTNI BROJEVI
Uveden za karakterizaciju položaja elektrona u atomu u skladu sa Schrödingerovom jednadžbom

1. Glavni kvantni broj(n)
Određuje energiju elektrona – energetski nivo
pokazuje veličinu elektronskog oblaka (orbitala)
uzima vrijednosti od 1 do
n (broj razine energije): 1 2 3 4, itd.
2. Orbitalni kvantni broj(l) :
određuje – orbitalni kutni moment elektrona
prikazuje oblik orbitale
uzima vrijednosti od 0 do (n -1)
Grafički je AO predstavljen orbitalnim kvantnim brojem: 0 1 2 3 4
Energetski podrazina: s p d f g
E se povećava
l =0 |
s –podrazina s –AO |
|
p- podrazina p-AO |
||
Svaki n odgovara određenom broju vrijednosti l, tj. Svaka energetska razina je podijeljena na podrazine. Broj podrazina jednak je broju razine.
1. energetska razina → 1 podrazina → 1s 2. energetska razina → 2 podrazine → 2s2p 3. energetska razina → 3 podrazine → 3s 3p 3d
4. energetska razina → 4 podrazine → 4s 4p 4d 4f itd.

3. Magnetski kvantni broj(ml)
određuje – vrijednost projekcije orbitalne kutne količine gibanja elektrona na proizvoljno odabranu os
prikazuje prostornu orijentaciju dd
uzima vrijednosti – od –l do +l
Bilo koja vrijednost l odgovara (2l +1) vrijednostima magnetskog kvantnog broja, tj. (2l +1) mogući položaji elektronskog oblaka određene vrste u prostoru.
s - stanje – jedna orbitala (2 0+1=1) - m l = 0, jer l = 0
p - stanje – tri orbitale (2 1+1=3)
m l : +1 0 -1, jer l =1
ml =+1 |
m l =0 |
m l = -1 |
Sve orbitale koje pripadaju istoj podrazini imaju istu energiju i nazivaju se degeneriranim.
Zaključak: AO karakterizira određeni skup n, l, m l, tj. određene veličine, oblik i orijentaciju u prostoru.

4. Spinski kvantni broj (ms)
"spin" - "vreteno"
određuje vlastiti mehanički moment elektrona povezan s njegovom rotacijom oko svoje osi
uzima vrijednosti – (-1/2· h/2) ili (+1/2· h/2)
n=3 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
l = 1 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
m l = -1, 0, +1 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
m s = + 1/2 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Načela i pravila

Elektroničke konfiguracije atoma
(u obliku elektroničkih konfiguracijskih formula)
Označite brojku energetske razine u brojevima
Energetska podrazina označena je slovima (s, p, d, f);
Eksponent podrazine označava broj
elektrona na ovoj podrazini
19 K 1s2 2s2 2p 6 3s 2 3p 6 4s 1
minimum
Elektroni u atomu zauzimaju najniže energetsko stanje, što odgovara njegovom najstabilnijem stanju.
1s 2s 2 p 3 s 3 p 3 d 4 s 4 p 4 d 4 f
Povećaj E
Klečkovski
Elektroni su postavljeni sekvencijalno u orbitale koje karakterizira povećanje zbroja glavnog i orbitalnog kvantnog broja (n+l); pri istim vrijednostima ovog zbroja, ranije se popunjava orbitala s manjom vrijednošću glavnog kvantnog broja n
1 s<2 s < 2 p = 3 s < 3 p = 4 s < 3 d = 4 p и т. д