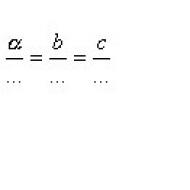§ xi.3. derivati ugljikovodika
MOU "Licej br. 47", Saratov
Nikitina Nadezhda Nikolaevna - učiteljica kemije
PRIPREMA ZA UPOTREBU (razred 10.11)
Test na temu: "Monohidrični alkoholi -
klasifikacija, nomenklatura, izomerija fizikalna i kemijska svojstva »
1 . Supstanca pentanol-2 odnosi se na:
1) primarni alkoholi, 2) sekundarni alkoholi; 3) tercijarni alkoholi; 4) dihidrični alkoholi.
2. Ograničenje monohidratnog alkohola nije:
1) metanol 2) 3-etilpentanol-13)2-fenilbutanol-1 4) etanol
3. Koliko izomernih spojeva odgovara formuli C 3 H 8 O koliko njih pripada alkanola?
1) 4 i 3 2) 3 i 3 3) 3 i 2 4) 2 i 2
4. Koliko izomera koji pripadaju klasi etera ima butanol-1?
1) Jedan 2) Dva 3) Tri 4) Pet
5. Izomer položaja funkcionalne skupine za pentanol-2 je:
1) pentanol-1 2) 2-metilbutanol-2 3) butanol-2 4) 3-metilpentanol-1
6. Koliko je primarnih, sekundarnih i tercijalnih alkohola navedeno u nastavku?
1) CH 3 CH 2 -OH 2) C 2 H 5 -CH(CH 3 )-CH 2 -OH 3) (CH 3 ) 3 C-CH 2 -OH
4) (CH 3 ) 3 C-OH e) CH 3 -CH (OH) -C 2 H 5 f) CH 3 -OH
1) primarno - 3, sekundarno - 1, tercijarno - 1 2) osnovno - 2, sekundarno - 2, tercijarno - 2
3) primarno - 4, sekundarno - 1, tercijarno - 1 4) osnovno - 3, sekundarno - 2, tercijarno - 1
7. Koja vrsta kemijske veze određuje odsutnost plinovitih tvari među hidroksi spojevima (u normalnim uvjetima)?
1) ionski 2) kovalentni 3) donor-akceptor 4) vodik
8. Vrelišta alkohola u usporedbi s vrelištem odgovarajućih ugljikovodika:
1) približno usporediv; 2) ispod; 3) viši; 4) nemaju jasnu međuovisnost.
9. Molekule alkohola su polarne zbog polariteta vodikove veze sa:
1) kisik; 2) dušik; 3) fosfor; 4) ugljik.
10. Odaberite točnu tvrdnju:
1) alkoholi su jaki elektroliti; 2) alkoholi dobro provode električnu struju;
3) alkoholi su neelektroliti; 4) alkoholi su vrlo slabi elektroliti.
11. Molekule alkohola povezane su zbog:
1) stvaranje intramolekularnih veza; 2) stvaranje kisikovih veza;
3) stvaranje vodikovih veza; 4) molekule alkohola nisu povezane.
12. Metanol ne stupa u interakciju s :
1) K 2) Ag 3) CuO 4) O 2
13. Etanol ne stupa u interakciju s :
1) NaOH 2) Na 3) Hcl 4) O 2
14. Koja od sljedećih tvari ne reagira s etanolom:
1) Na 2) NaOH 3) HBr 4) O 2
15. Propanol ne stupa u interakciju s:
1) Hg 2) O 2 3) HC l 4) K
16. Etanol ne reagira s:
1) Na 2) CuO 3) HCOOH 4) CuSO 4
17. Ograničavajući monohidratni alkoholi karakteriziraju interakciju sa:
1) KOH (otopina) 2) K 3) Cu (OH) 2 4) Cu
18. Kada se primarni butil alkohol oksidira,:
1) propanal; 2) butir aldehid; 3) etanal; 4) metanal.
19. Prilikom oksidacije (dehidrogenacije) sekundarnog alkohola dobiva se:
1) tercijarni alkohol 2) aldehid 3) keton 4) karboksilna kiselina.
20. Koja od tvari koje sadrže hidroksil tijekom dehidrogenacije prelazi u keton:
1) metanol 2) etanol 3) propanol-2 4) o-krezol.
21. Tijekom oksidacije butanola-1 nastaje:
1) keton 2) aldehid 3) kiselina 4) alken
22. Kada se metanol oksidira, nastaje:
1) metan 2) octena kiselina 3) metanal 4) klorometan
23. Kada se propanol-2 oksidira, nastaje:
1) aldehid 2) keton 3) alkan 4) alken
24. Kada se metanol zagrijava s kisikom na bakrenom katalizatoru, nastaje sljedeće:
1) formaldehid 2) acetaldehid 3) metan 4) dimetil eter
25. Kada se etanol zagrijava s kisikom na bakrenom katalizatoru, nastaje sljedeće:
1) eten 2) acetaldehid 3) dietil eter 4) etandiol
26. Jedan od proizvoda reakcije koji nastaje kada se metanol zagrije s koncentriranim. sumporne kiseline, je:
1) CH 2 \u003d CH 2 2) CH 3 -O-CH 3 3) CH 3 Cl 4) CH 4
27. Tijekom intramolekularne dehidracije butanola-1 nastaje:
1) buten-1 2) buten-2 3) dibutil eter 4) butanal.
28. Intramolekularna dehidracija alkohola dovodi do stvaranja:
1) aldehidi 2) alkani 3) alkeni 4) alkini
29. Koja tvar nastaje kada se etilni alkohol zagrije na 140 O C u prisutnosti koncentrirane sumporne kiseline?
1) acetaldehid 2) dimetil eter 3) dietil eter 4) etilen
30. Kisela svojstva etanola očituju se u reakciji sa
1) natrij 2) bakrov oksid (II)
3) klorovodik 4) zakiseljena otopina kalijevog permanganata
31. Koja reakcija ukazuje na slaba kisela svojstva alkohola:
1) s Na 2) s NaOH 3) s NaHCO 3 4) s CaO
32. Alkoholati se dobivaju iz alkohola kada su u interakciji sa:
1) K MnO4; 2) O 2 3) CuO 4) Na
33. Kada propanol-1 stupi u interakciju s natrijem, nastaje sljedeće:
1) propen; 2) natrijev propilat 3) natrijev etoksid 4) propandiol-1,2
34. Pri izlaganju alkoholima alkalnih metala nastaju:
1) karbonati koji se lako hidroliziraju; 2) karbonati koji se teško hidroliziraju;
3) alkoholati koji se teško hidroliziraju; 4) alkoholati koji se lako hidroliziraju.
35. Koja tvar nastaje u reakciji pentanola-1 s kalijem?
1) C5H12 OK; 2) C5H11 OK; 3) C6H11 OK; 4) C 6 H 12 OK.
36. Tvar koja reagira saNa , ali ne reagira sNaOH , nakon dehidracije, davanje alkena je:
1) fenol; 2) alkohol 3) prosti eter; 4) alkan
37. Koji od sljedećih alkohola najaktivnije reagira s natrijem?
1) CH 3 CH 2 OH 2) CF 3 CH 2 OH 3) CH 3 CH (OH) CH 3 4) (CH 3) 3 C-OH
38. Koja je molekulska formula produkta reakcije pentanola-1 s bromovodikom?
1) C6H11Br; 2) C5H12Br; 3) C5H11Br; 4) C6H12Br.
39. Tijekom reakcije etanola sa klorovodičnom kiselinom u prisutnosti H 2 SO 4,
1) etilen 2) kloroetan 3) 1,2-dikloretan 4) vinil klorid
40. Iz etanola, butan se može dobiti sekvencijalnim djelovanjem
1) bromovodik, natrij 2) brom (zračenje), natrij
3) koncentrirana sumporna kiselina (t> 140°), vodik (katalizator, t°)
4) bromovodik, alkoholna otopina natrijevog hidroksida
odgovori:
1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 | |
1 | ||||||||||||||||||||
2 | ||||||||||||||||||||
3 | ||||||||||||||||||||
4 |
21 | 22 | 23 | 24 | 25 | 26 | 27 | 28 | 29 |
Predavanje 8. Alkoholi (hidroksi spojevi)
Derivati ugljikovodika dobiveni zamjenom jednog ili više atoma vodika s OH skupinom (hidroksi skupina).
Klasifikacija
- 1. Prema strukturi lanca (ograničavajući, neograničavajući).
- 2. Po atomičnosti - jednoatomni (jedna OH skupina), poliatomski (2 ili više OH skupina).
- 3. Prema položaju OH skupine (primarna, sekundarna, tercijarna).
Ograničite monohidrične alkohole
Opća formula C n H 2n+1 OH
|
homologni niz |
Radikalno-funkcionalna nomenklatura, karbinal |
|
|
Metilni alkohol, karbinol, metanol |
||
|
Etilni alkohol, metilkarbinol, etanol |
||
|
propil alkohol, etil karbinol, 1-propanol |
||
|
izopropil alkohol, dimetilkarbinol, 2-propanol |
||
|
S 4H9OH |
CH3-CH2-CH2-CH2OH |
butil alkohol, propil karbonat, 1-butanol |
|
Sekundarni butil alkohol, metiletilkarbinol, 2-butanol |
||
|
izobutil alkohol, izopropil karbinol, 2-metil-1-propanol |
||
|
Tercijarni butil alkohol, trimetilkarbinol, dimetiletanol |
Prema sustavnoj nomenklaturi (IUPAC), alkoholi se nazivaju prema ugljikovodiku koji odgovara najdužem lancu ugljikovih atoma s dodatkom na kraju "ol",
Numeriranje počinje od kraja najbližeg kojem se nalazi OH skupina.
izomerija
1. Strukturno - lančana izomerija
izomerija položaja hidroksi skupine

2. Prostorno - optičko, ako su sve tri skupine ugljika povezane s OH skupinom različite, na primjer:
Priznanica
- 1. Hidroliza halogenih alkila (vidi svojstva halogenih derivata).
- 2. Organometalna sinteza (Grignardove reakcije):
- a) primarni alkoholi se dobivaju djelovanjem organometalnih spojeva na formaldehid:
CH 3 -MgBr + CH 2 \u003d O CH 3 -CH 2 -O-MgBr CH 3 -CH 2 OH + MgBr (OH)
b) sekundarni alkoholi nastaju djelovanjem organometalnih spojeva na druge aldehide:

c) tercijarni alkoholi - djelovanjem organometalnih spojeva na ketone:
3. Obnavljanje aldehida, ketona:

4. Hidratacija olefina (vidi svojstva olefina)
Elektronička i prostorna struktura
Razmotrimo primjer metilnog alkohola

Kut bi trebao biti 90 0 , zapravo je 110 0 28 / . Razlog je visoka elektronegativnost kisika, koji privlači elektronske oblake C-H i O-C veza orbitala.
Budući da vodik hidroksilne skupine ima svoj jedini elektron koji vuče kisik, jezgra vodika stječe sposobnost da se privuče drugim elektronegativnim atomima koji imaju nepodijeljene elektrone (atomi kisika).
Fizička svojstva
C 1 -C 10 - tekućine, C 11 i više - krute tvari.
Vrelište alkohola je puno veće od vrelišta odgovarajućih ugljikovodika, halogenih derivata i etera. Ovaj fenomen se objašnjava činjenicom da su molekule alkohola povezane zbog stvaranja vodikovih veza.

Suradnici nastaju od 3-8 molekula.
Tijekom prijelaza u stanje pare, vodikove veze se razaraju, a na to se troši dodatna energija. To podiže točku vrenja.
T bale: za primarno > za sekundarno > za tercijarno
T pl - naprotiv: u tercijarnom > u sekundarnom > u primarnom
Topljivost. Alkoholi se otapaju u vodi, stvarajući vodikove veze s vodom.
C 1 -C 3 - miješati neograničeno;
C4-C5 - ograničen;
oni viši su netopivi u vodi.
Gustoća alkoholi<1.
Spektralna karakteristika alkohola
Navedite karakteristične apsorpcijske pojaseve u IR području. 3600 cm -1 (apsorbira nevezanu OH skupinu) i 3200 cm -1 (u stvaranju vodikovih veza - pridružena OH skupina).
Kemijska svojstva
Uzrokuje prisutnost OH skupine. Određuje najvažnija svojstva alkohola. Mogu se razlikovati tri skupine kemijskih transformacija koje uključuju OH skupinu.
I. Reakcije supstitucije vodika u hidroksi skupini.
- 1) Stvaranje alkoholata
- a) djelovanje alkalnih metala i nekih drugih aktivnih metala (Mg, Ca, Al)
Alkoholati se potpuno razgrađuju vodom uz nastajanje alkohola i lužina.
C 2 H 5 Ona + HOH C 2 H 5 OH + NaOH
b) Reakcija Chugaev-Tserevitinov - djelovanje organomagnezijevih spojeva.
C 2 H 5 OH + CH 3 MgBr C 2 H 5 OmgBr + CH 4
Reakcija se koristi u analizi alkohola za određivanje količine "mobilnog vodika". U tim reakcijama alkoholi pokazuju vrlo slaba kisela svojstva.
- 2) Stvaranje estera na kiselinskom ostatku – acil.
- a) Reakcija esterifikacije – interakcija alkohola s karboksilnim kiselinama.

Metodom obilježenih atoma utvrđeno je da je reakcija esterifikacije zamjena OH skupine alkoksi grupom. Ova reakcija je reverzibilna, jer nastala voda uzrokuje hidrolizu estera.
b) Aciliranje alkohola anhidridima kiselina.

Ova reakcija je reverzibilna, jer kada alkohol stupi u interakciju s anhidridom, voda se ne oslobađa (hidroliza nije moguća).
c) aciliranje alkohola kiselinskim kloridima

3) Stvaranje etera
Eteri nastaju kao rezultat zamjene vodika hidroksi skupine s alkilom (alkilacija alkohola).
a) alkilacija s alkil halogenidima
C 2 H 5 OH + ClCH 3 HCl + C 2 H 5 OCH 3
b) alkilacija s alkil sulfatima ili dialkil sulfatima
C2H5OH + CH3O-SO2OH C2H5OCH3 + H2SO4
C 2 H 5 OH + CH 3 OSO 2 OCH 3 C 2 H 5 OCH 3 + HOSO 2 OCH 3
c) intermolekularna dehidracija u prisutnosti čvrstog katalizatora
C 2 H 5 OH + HOC 2 H 5 C 2 H 5 OC 2 H 5 + H 2 O
- 240 0C
- d) alkilacija s izoolefinima

II. Reakcije s apstrakcijom OH skupine.
- 1) Supstitucija OH grupe s Hal.
- a) djelovanje HHala;
- b) djelovanje PHal i PHal 5 ;
- c) djelovanje SOCl 2 i SO 2 Cl 2 (vidi metode za dobivanje halogenih derivata).
- 2) dehidracija alkohola (intramolekularna eliminacija vode)
Eliminacija vodika dolazi iz najmanje hidrogenirane od 2 susjedne veze s onima koje sadrže hidroksil (Zaitsevovo pravilo).
III. Oksidacija i dehidrogenacija alkohola
Omjer alkohola i oksidacije povezan je s induktivnim učinkom C-O veze. Polarna C-O veza povećava mobilnost atoma vodika na ugljiku povezanom s OH skupinom.

- 1) Oksidacija primarnih alkohola
- a) na aldehide;

b) na kiseline
2) Oksidacija sekundarnih alkohola ide u ketone

3) Tercijarni alkoholi ne oksidiraju u sličnim uvjetima, jer nemaju mobilni atom ugljika povezan s OH skupinom. Međutim, pod djelovanjem jakih oksidacijskih sredstava (koncentrirane otopine na visokoj temperaturi), oksidacijska reakcija se odvija s uništavanjem ugljikovog lanca. U tom slučaju susjedne jedinice (najmanje hidrogenirane) podliježu oksidaciji. tu je izraženiji indukcijski učinak hidroksilne skupine.

4) Dehidrogenacija alkohola – pod djelovanjem katalizatora.
Također se događa uz sudjelovanje najmobilnijih atoma vodika: vodika hidroksi skupine i vodika na susjednom atomu ugljika.

Dehidrogenacija pod djelovanjem klora.

Primarni alkoholi su najaktivniji u reakcijama supstitucije i eliminacije vodika, dok u reakcijama supstitucije i eliminacije OH skupine, naprotiv, najlakše reagiraju tercijarni alkoholi.
NEZASIĆENI ALKOHOLI
i već u procesu stvaranja izomeriziraju u odgovarajuće aldehide ili ketone, tk. dolazi do p-konjugacije, povećava se mobilnost vodika i povećava se nukleofilnost CH2.

Kako doći
Osim općih metoda za dobivanje alkohola, koriste se sljedeće:
a) za dobivanje acetilenskih alkohola - reakcija interakcije acetilena s aldehidima i ketonima (vidi kemijska svojstva acetilenskih ugljikovodika).

b) zagrijavanje glicerola s oksalnom kiselinom

Svojstva
Daju reakcije alkohola i reakcije zbog višestrukih veza. Lako se oksidira, polimerizira.
Pojedinačni predstavnici
Vinil alkohol
Ne postoji u slobodnom stanju. Međutim, industrija proizvodi niz svojih derivata, kao npr
vinil acetat
metil vinil eter
Koristi se za dobivanje polimera, na primjer, PVA:
koristi se za dobivanje kirurške upijajuće svile.
alil alkohol
CH 2 \u003d CH-CH 2 OH se dobiva iz propilena
Koristi se kao monomer u proizvodnji smola i plastike.
Propargil alkohol
Koristi se za dobivanje glicerina, alil alkohola, kao otapalo za visokomolekularne spojeve (poliamidi, acetati, celuloza), kao jedkalo u galvaniziranim metalnim prevlakama.
Polihidrični alkoholi
Načini dobivanja (osim općih)
1. Od olefina

2. Od acetilena (vidi svojstva acetilena)
- 3. Od prirodnih tvari
- a) hidroliza masti - glicerol;
- b) obnavljanje monosaharida - eritritola, pentita, heksita.
Fizička svojstva
Glikoli i gliceroli su guste sirupaste tekućine s vrlo visokim vrelištem (200-300 0 C), vrlo higroskopne.
Tetriti – heksiti – čvrste bezbojne kristalne tvari. Vrlo su topljivi u vodi, slatkog su okusa i tijelo ih apsorbira.
Kemijska svojstva
1) imaju jača kiselinska svojstva od monohidričnih alkohola. S Cu(OH) 2 tvore kompleksne alkoholate. U tom se slučaju plavi precipitat Cu (OH) 2 otapa u polihidričnom alkoholu uz stvaranje plave otopine (kvalitativne reakcije za polihidrične alkohole):

2) sposoban za stvaranje cikličkih etera

Posljednja reakcija je teška, pa se praktički koriste neizravne metode.
- 3) Formirajte otvorene etere
b) esteri


4) Reakcije oksidacije se nastavljaju postupno:

Zamjenom jednog ili više atoma vodika u ugljikovodici s drugim atomima ili skupinama atoma, zvanim funkcionalne skupine, dobivaju se derivati ugljikovodika: halogeni derivati, alkoholi, aldehidi, ketoni, kiseline itd. Uvođenje jedne ili druge funkcionalne skupine u sastav spoja, u pravilu, radikalno mijenja svoja svojstva. Na primjer, uvođenje karboksi skupine - dovodi do pojave kiselih svojstava u organskim spojevima. Skraćena formula derivata ugljikovodika može se napisati kao gdje je ostatak ugljikovodika (radikal), F je funkcionalan
skupina. Na primjer, karboksilna kiselina može se općenito predstaviti formulom
Halogeni derivati ugljikovodika.
Formula halogeniranog ugljikovodika može se predstaviti kao gdje je halogen; je broj atoma halogena. Zbog polarnosti veze halogen-ugljik, halogen se relativno lako zamjenjuje za druge atome ili funkcionalne skupine, pa se halogeni derivati ugljikovodika široko koriste u organskoj sintezi. Jačina veze ugljik-halogen raste od joda do fluora; stoga fluorougljici imaju visoku kemijsku stabilnost. Halogeni derivati ugljikovodika imaju široku primjenu u strojarstvu. Stoga se mnogi od njih (diklormetan, tetraklorometan, dikloretan itd.) koriste kao otapala.
Zbog visoke topline isparavanja, nesagorivosti, netoksičnosti i kemijske inertnosti, fluorougljici i miješani halogeni derivati našli su primjenu kao radni fluidi u rashladnim uređajima - freoni (freoni), na primjer: (freon 12), (freon (freon 22 ), (freon 114) U vezi s masovnom upotrebom freona (freona) nastao je problem sprječavanja njihovog štetnog djelovanja na okoliš, budući da se freoni isparavanjem razgrađuju, a halogeni, posebno fluor, stupaju u interakciju s ozonskim omotačem. .
Halogeni derivati zasićenih ugljikovodika, na primjer, služe kao polazni monomeri za proizvodnju vrijednih polimera (polivinil klorid, fluoroplast).
Alkoholi i fenoli.
Alkoholi su derivati ugljikovodika u kojima je jedan ili više atoma vodika zamijenjeno hidroksidnim skupinama. Ovisno o ugljikovodicima, alkoholi se dijele na zasićene i nezasićene, prema broju hidroksidnih skupina u spoju, razlikuju se jednoatomne (npr. i polihidrične (npr. glicerinski alkoholi). Ovisno o broju ugljikovih atoma spojenih na atom ugljika na kojem se nalazi hidroksidna skupina, razlikuju primarni
sekundarni i tercijarni alkoholi.
Naziv alkohola dobiva se dodavanjem sufiksa imenu ugljikovodika (ili -diol, triol, itd. u slučaju polihidričnih alkohola), kao i navođenjem broja ugljikovog atoma na kojem se nalazi hidroksidna skupina , na primjer:


Zbog polariteta veze kisik-vodik, molekule alkohola su polarne. Niži alkoholi su vrlo topljivi u vodi, međutim, kako se broj ugljikovih atoma u ugljikovodičnom radikalu povećava, učinak hidroksidne skupine na svojstva opada i topljivost alkohola u vodi se smanjuje. Molekule alkohola povezane su zbog stvaranja vodikovih veza između njih, pa su njihova vrelišta viša od vrelišta odgovarajućih ugljikovodika.
Alkoholi su amfoterni spojevi; kada su izloženi alkalnim metalima, nastaju alkoholati koji se lako hidroliziraju:
Pri interakciji s halogenovodonična kiselina dolazi do stvaranja halogenih derivata ugljikovodika i vode:
Međutim, alkoholi su vrlo slabi elektroliti.
Najjednostavniji od zasićenih alkohola je metanol, koji se dobiva iz ugljičnog monoksida i vodika pod pritiskom, na povišenoj temperaturi u prisutnosti katalizatora:
S obzirom na relativnu jednostavnost sinteze metanola, mogućnost dobivanja početnih reagensa iz ugljena, neki znanstvenici sugeriraju da će metanol u budućnosti naći širu primjenu u tehnologiji, uključujući transportnu energiju. Mješavina metanola i benzina može se učinkovito koristiti u motorima s unutarnjim izgaranjem. Nedostatak metaiola je njegova visoka toksičnost.
Etanol se proizvodi fermentacijom ugljikohidrata (šećera ili škroba):
U tom slučaju kao sirovina služe ili prehrambeni proizvodi ili celuloza koja se hidrolizom pretvara u glukozu. Posljednjih godina sve se više koristi metoda katalitičke hidratacije etilena:
Korištenje metode hidrolize celuloze i hidratacije etilena omogućuje uštedu prehrambenih sirovina. Iako je etanol jedan od najmanje otrovnih alkohola, on značajno ubija
više ljudi od bilo koje druge kemikalije.
Kada se vodik aromatskog prstena zamijeni hidroksidnom skupinom, nastaje fenol. Pod utjecajem benzenskog prstena povećava se polaritet veze kisik-vodik, pa se fenoli disociraju u većoj mjeri od alkohola i pokazuju kisela svojstva. Atom vodika u hidroksidnoj skupini fenola može se zamijeniti metalnim kationom pod utjecajem baze:

Fenol se široko koristi u industriji, a posebno služi kao sirovina za proizvodnju fenol-formaldehidnih polimera.
Aldehidi i ketoni.
Tijekom oksidacije i katalitičke dehidrogenacije alkohola mogu se dobiti aldehidi i ketoni - spojevi koji sadrže karbonilnu skupinu

Kao što vidite, kada se primarni alkohol oksidira ili dehidrogenira, dobiva se aldehid, dok je sekundarni alkohol keton. Ugljikov atom karbonilne skupine aldehida vezan je na jedan atom vodika i jedan atom ugljika (radikal). Ugljikov atom karbonilne skupine ketona vezan je za dva ugljikova atoma (s dva radikala).
Imena aldehida i ketona izvedena su iz imena ugljikovodika dodavanjem sufiksa -al za aldehid i -one za keton, na primjer:

Veza kisik - ugljik karbonilne skupine aldehida je jako polarizirana, stoga aldehide karakterizira visoka reaktivnost, dobra su redukcijska sredstva, lako ulaze u reakcije supstitucije, adicije, kondenzacije i polimerizacije. Najjednostavniji aldehid - metanal (formaldehid ili mravlji aldehid) sklon je
spontana polimerizacija. Koristi se za dobivanje fenol-formaldehidnih i urea-formaldehidnih smola i poliformaldehida.
Ketoni su manje reaktivni od aldehida jer je karbonilna skupina manje polarna. Stoga ih je teže oksidirati, reducirati i polimerizirati. Mnogi ketoni, posebno aceton, dobra su otapala.
karboksilne kiseline.
U karboksilnim kiselinama funkcionalna skupina je karboksilna skupina -COOH. Ovisno o broju karboksilnih skupina u molekuli kiseline dijele se na jedno-, dvo- i polibazične, a ovisno o radikalu pridruženom karboksilnoj skupini, na alifatske (granične i nezasićene), aromatske, alicikličke i heterocikličke. Prema sustavnoj nomenklaturi, nazivi kiselina potječu od naziva ugljikovodika, dodajući završetak -ovaya i riječ kiselina, na primjer - butanska kiselina.
Međutim, često se koriste trivijalni nazivi koji su se povijesno razvili, na primjer:

Kiseline se obično dobivaju oksidacijom aldehida. Na primjer, kada se acetilen hidratizira, nakon čega slijedi oksidacija nastalog acetaldehida, dobiva se octena kiselina:
Nedavno je predložena metoda za proizvodnju octene kiseline koja se temelji na reakciji metanola s ugljičnim monoksidom u prisutnosti rodijevog katalizatora.
![]()
Kisela svojstva karboksilne skupine posljedica su eliminacije protona tijekom elektrolitičke disocijacije kiselina. Eliminacija protona povezana je sa značajnom polarizacijom O-H veze, uzrokovanom pomakom u gustoći elektrona s atoma ugljika na atom kisika karboksilne skupine

Sve karboksilne kiseline su slabi elektroliti i kemijski se ponašaju kao anorganske slabe kiseline. Oni međusobno djeluju s oksidima i hidroksidima metala, tvoreći soli.
Jedna od značajki karboksilnih kiselina je njihova interakcija s halogenom, što dovodi do stvaranja halogen-supstituiranih karboksilnih kiselina. Zbog prisutnosti halogena u molekuli kiseline, O-H veza je polarizirana, pa su halogenom supstituirane kiseline jače od izvornih karboksilnih kiselina. Kiseline tvore estere s alkoholima
Ili amini, poput amonijaka, pokazuju osnovna svojstva.
U reakciji s kiselinama stvaraju soli
Amini su sirovina za proizvodnju boja, makromolekularnih i drugih spojeva.